Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Пути использования глицина и серинаСодержание книги
Поиск на нашем сайте
ПУТИ ИСПОЛЬЗОВАНИЯ ГЛИЦИНА И СЕРИНА Несмотря на простоту строения, глицин и серин являются весьма востребован-ными аминокислотами в клетках. Они могут превращаться друг в друга. Роль реакции превращения серина в глицин состоит в образовании активной Формы ТГФК-N5,N10-метилен-ТГФК.
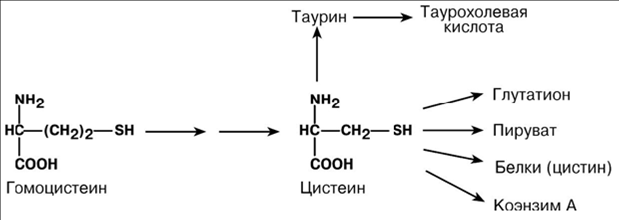
ВЗАИМОСВЯЗЬ ОБМЕНА ГЛИЦИНА, СЕРИНА И МЕТИОНИНА Реакции метилирования являются распространенными в организме. Они необхо-димы для синтеза ряда веществ – креатина, холина, карнитина, адреналина, фос-фатидилхолина, нуклеотидов в ДНК и РНК, гистонов, чужеродных веществ, в том числе лекарственных соединений. Источником метильной группы для этих реакций является S-аденозилметионин и производные тетрагидрофолиевой кислоты (ТГФК). Образованный в реакции распада серина до глицина N5,N10-метилен-ТГФК пре-вращается в N5-метил-ТГФК. N5-Метил-ТГФК участвует в реакции реметилирования гомоцистеина в метионин. Последний впоследствии присоединяет аденозильный ос-таток и превращается в активную форму метионина – S-аденозилметионин, участ-вующий во многих реакциях метилирования.
ПУТИ ИСПОЛЬЗОВАНИЯ ЦИСТЕИНА
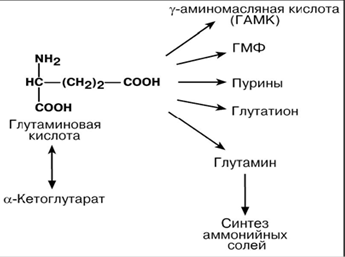
ПУТИ ИСПОЛЬЗОВАНИЯ ГЛУТАМИНОВОЙ И АСПАРАГИНОВОЙ КИСЛОТ
Деградация аминокислот: общие сведения Углеродные скелеты 20 белковых аминокислот (см. с. 66) превращаются в итоге в семь различныхпродуктов деградации (на схеме окрашены в розовый и светло-голубой цвета). Пять метаболитов (2-оксоглутарат, сукцинил-КоА, фумарат, оксалоацетат и пируват) служат предшественниками в процессе глюконеогенеза (см. с. 156). Первые четыре являются еще и промежуточными продуктами цитратного цикла, в то время как пируват может быть переведен пируватдекарбоксилазой в оксалоацетат и тем самым стать участником глюконеогенеза (зеленая стрелка). Аминокислоты, деградация которых поставляет один из пяти упомянутых метаболитов, называются глюкогенными аминокислотами. За двумя исключениями (лизин и лейцин, см. ниже) глюкогенными являются все белковые аминокислоты. Два других продукта распада (ацетоацетат и ацетил-КоА) не могут включаться в глюконеогенез в организме животных. Они используются для синтеза кетоновых тел, жирных кислот и изопреноидов (см. сс. 174, 304). Поэтому аминокислоты, которые разрушаются с образованием ацетил-КоА или ацетоацетата, называются кетогенными аминокислотами. Фактически кетогенными являются только лейцин и лизин. Некоторые аминокислоты поставляют продукты деградации, являющиеся глюкогенами и кетогенами. К этой группе принадлежат фенилаланин, тирозин, триптофан и изолейцин. Существует несколько путей удаления аминогруппы во время распада аминокислоты (дезаминирования). Обычно NH2-группа переносится путем трансаминирования на 2-оксоглутарат (см. с. 180, желтые метки на схеме). Образующийся глутамат в дальнейшем вновь превращается в 2-оксоглутарат с помощью глутаматдегидрогеназы (окислительное дезаминирование, зеленая метка). В этой реакции образуется свободный аммиак (NH3), который у высших животных превращается в мочевину и выводится из организма (см. с. 184). Аммиак освобождается также при гидролизе амидных групп аспарагина и глутамина (гидролитическое дезаминирование, оранжевая метка). Другим превращением, при котором образуется NH3, является элиминирующее дезаминированиесерина в пируват (голубая метка, см. с. 402). ДЕКАРБОКСИЛАЗА АМИНОКИСЛОТ фермент, катализирующий декарбоксилирование (отщепление СО2 от карбоксильной группы) аминокислот. Ко-ферментом Д. а. является пиридоксаль-5-фосфат — производное витамина B6 (пиридоксина). Г И С Т А М И Н Реакция образования гистамина наиболее активно идет в тучных клетках, Филах и эозинофилах. В них гистамин синтезируется и накапливается в секреторных Гранулах.
В кровь гистамин выделяется при повреждении ткани, при ударе, электрическом Раздражении. В клинической практике секреция гистамина обычно связана с аллер- Гиями – при повторном попадании антигена в ранее сенсибилизированный организм Развивается аллергическая реакция. Физиологические эффекты С Е Р О Т О Н И Н Ких, печени.
Физиологические эффекты Ный шар).
Физиологические эффекты В центральной нервной системе является тормозным медиатором; Ткани.
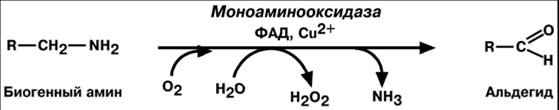
Упрощенная схема транспорта кислорода и углекислого газа в организме при нормальных условиях выглядит следующим образом: во время вдоха кислород проникает через альвеолярную легочную мембрану и связывается с гемоглобином красных клеток крови — эритроцитов. Эритроциты доставляют кислород к тканям. Там гемоглобин, восстанавливаясь, отдает кислород и присоединяет углекислый газ. Возвращаясь в лёгкие, гемоглобин вновь окисляется и отдает углекислый газ, который удаляется из организма с выдохом. Аминооксидазы условно выделяют в два класса: моноаминооксидазы (сокращённо - МАО), катализирующие распад веществ с одной аминогруппой, и полиаминооксидазы, расщепляющие вещества с двумя и более аминогруппами. Например, МАО осуществляет разрушение катехоламинов - адреналина, норадреналина, дофамина и других. МАО прикреплены к мембранам внутриклеточных органелл - митохондрий, и поэтому они разрушают только те катехоламины, которые локализуются внутри клеток. 5.Зубная эмаль (или просто эмаль) — внешняя защитная оболочка верхней части зубов человека. Эмаль является самой твёрдой тканью в организме человека, что объясняется высоким содержанием неорганических веществ — до 97 %. Воды в зубной эмали меньше, чем в остальных органах, 2—3 %. Твёрдость достигает 397,6 кг/мм² (250—800 по Виккерсу). Толщина слоя эмали отличается на различных участках коронковой части зуба и может достигать 2,0 мм, а у шейки зуба сходит на нет. Химический состав Твёрдость зубной эмали определяется высоким содержанием в ней неорганических веществ (до 97 %), главным образом кристаллов апатитов: гидроксиапатита — Ca10(PO4)6(OH)2 (до 75,04 %), карбонатапатита (12,06 %), хлорапатита (4,397 %), фторапатита (3,548 %), CaCO3 (2,668 %), MgCO3(2,287 %) и др. Здоровая эмаль содержит 3,8 % свободной воды и 1,2 % органических веществ (белков, липидов, углеводов). Углеводы эмали представлены глюкозой, маннозой, галактозой и др. Вода занимает свободное пространство в кристаллической решётке и органической основе, а также располагается между кристаллами. Гидроксиапатиты очень восприимчивы к кислотам, поэтому разрушение эмали начинается уже при pH 4,5. Зубная эмаль — это прозрачная, тонкая и самая твердая ткань зуба. Она покрывает всю зубную поверхность и играет очень важную защитную роль. Поэтому её называют «минеральным колпачком». На 97% зубная эмаль состоит из минеральных веществ, из которых 35% составляет кальций и 17% фосфор. Процентное соотношение минеральных веществ в эмали зависит от возраста человека и от условий внешней среды (наличия микроэлементов в пище и воде). Повреждения зубной эмали ведут неизбежно к кариесу и дальнейшему разрушению зуба.
Эмаль - это бессосудистая и самая твердая ткань организма. Кроме того, эмаль остается относительно неизменной в течение всей жизни человека. Указанные свойства объясняются функцией, которую она выполняет — защищает дентин и пульпу от внешних механических, химических и температурных раздражителей. Только благодаря этому зубы выполняют свое назначение — откусывают и измельчают пищу. Структурные особенности эмали приобретены в процессе филогенеза. Явление проницаемости эмали зуба осуществляется благодаря смыванию зуба (эмали) снаружи ротовой жидкостью, а со стороны пульпы — тканевой и наличию пространств в эмали, заполненных жидкостью. Возможность проникновения в эмаль воды и некоторых ионов известна с конца прошлого и начала нашего столетия. Так, стало известно, что зубная лимфа может проходить через эмаль, нейтрализуя молочную кислоту и постепенно увеличивая плотность за счет содержащихся в ней минеральных солей. Эмалево-дентинное соединение образовано мембраной, которая на ранних стадиях представлена некальцифицированными коллагеновыми волокнами, отделяющими эмаль от дентина (рис. 18,а). В дальнейшем она минерализуется и является местом соединения кристаллов эмали и дентина (рис. 18,б). Группы призм эмали, как и волокнистые структуры, из одной ткани глубоко вдаются в другую, придавая эмалево-дентинному соединению чашеобразный вид. Органические вещества эмали
Доля орг.в-в 1 – 1,5%. В незрелой эмали до 20%. Орг.в-ва эмали влияют на биохимические и физические процессы, происходящие в эмали зуба. Орг.в-ва нах-ся между кристаллами апатита в виде пучков, пластинок или спирали. Осн.представители – белки, углеводы, липиды, азотсодержащие в-ва (мочевина, пептиды, цикл.АМФ, цикл.аминокислоты).
Белки и углеводы входят в состав органич.матрицы. Все процессы реминерализации происходят на основе белковой матрицы. Большая часть представлена коллагеновыми белками. Они обладают способностью инициировать реминерализацию. 1. а) белки эмали – нерастворимы в кислотах, 0,9% ЭДТА. Они относятся к коллаген- и керамидо- подобным белкам с большим количеством сер, оксипролина, гли, лиз. Эти белки играют защитную ф-цию в процессе деминерализации. Не случайно в очаге деминерализации на ст.белого или пигментированного пятна кол-во этих белков > в 4 раза. Поэтому кариозное пятно в течение нескольних лет не превращается в кариозную полость, а иногда вообще не развивается кариес. У пожилых людей к кариесу > резистентность. б) кальцийсвязывающие белки эмали. КСБЭ. Содержат ионы Са в нейтральной и слабощелочной среде и способствуют проникновению Са из слюны в зуб и обратно. На долю белков А и Б приходится 0,9% от общей массы эмали. 2. Б.растворимые в воде не связанные с минеральными в-вами. Они не обладают сродством к минер.компонентам эмали, не могут образовывать комплексы. Таких белков 0,3%. 3. Своб.пептиды и отд.аминокислоты, такие как промин, гли, вал, оксипролин, сер. До 0,1% 1) ф-я защитная. Белки окружают кристалл. Предупреждают процесс деминерализации 2) белки инициируют минерализацию. Активно участвуют в этом процессе 3) обеспечивают минер.обмен в эмали и др.твердых тканях зуба. Углеводы представлены полисахаридами: глюкоза, галактоза, фруктоза, гликоген. Дисахариды нах-ся в свободной форме, а образуются белковые комплексы – фосфо-гликопротеиды. Липидов очень мало. Представлены в виде гликофосфолипидов. При образовании матрицы они выполняют роль связующих мостиков между белками и минералами. 6.После прорезывания образованная из остатков погибших уплощенных наружных клеток эмалевого органа тонкая пленка – кутикула на жевательных поверхностях стирается. Зрелая эмаль инертна, не содержит клеток и поэтому неспособна к регенерации при повреждениях. Однако имеет место минимальный обмен ионами между эмалью и слюной, благодаря чему на поверхности эмали может происходить минимальное дополнительное обызвествление в виде пленки – пелликула. При недостаточно хорошем гигиеническом уходе за зубами на поверхности эмали образуется зубной налет – скопление микроорганизмов, продукты жизнедеятельности которых изменяет местную РН в кислую сторону, что в свою очередь обуславливает вымывание солей кольция, т.е. может стать началом кариеса. При отложении солей в очагах зубного налета образуются зубные камни.
Главный компонент органических веществ зубной ткани - коллаген I типа. Углеводы и липиды присутствуют в небольших количествах. Содержание органических веществ в твёрдых частях зуба варьирует от 2% (эмаль) до 30% (дентин и цемент). Содержание органических веществ в мягких частях зуба такое же, как в соответствующих видах соединительной ткани. В настоящее время проницаемость эмали изучена довольно подробно, что позволило пересмотреть ряд ранее существовавших представлений. Если ранее считали, что вещества в эмаль поступают по пути пульпа — дентин — эмаль, то в настоящее время не только установлена возможность поступления веществ в эмаль из слюны, но и доказано, что этот путь является основным. Эмаль проницаема в обоих направлениях: от поверхности эмали к дентину и пульпе и от пульпы к дентину и поверхности эмали. На этом основании эмаль зуба считают полупроницаемой мембраной. Проницаемость — главный фактор созревания эмали зубов после прорезывания. В зубе проявляются обычные законы диффузии. При этом вода (эмалевая жидкость) проходит со стороны малой молекулярной концентрации в сторону высокой, а молекулы и диссоциированные ионы — со стороны высокой концентрации в сторону низкой. Иначе говоря, ионы кальция перемещаются из слюны, которая пересыщена ими, в эмалевую жидкость, где их концентрация низкая. В настоящее время имеются бесспорные доказательства проникновения в эмаль и дентин зуба из слюны многих неорганических и органических веществ. Показано, что при нинесении на поверхность интактной эмали раствора радиоактивного кальция он уже через 20 мин обнаруживался в поверхностном слое. При более длительном контакте раствора с зубом радиоактивный кальций проникал на всю глубину эмали до эмалево-дентинного соединения. Аналогичными исследованиями установлено включение радиоактивного фосфора в дентин и эмаль интактного зуба животного после внутри-ионного введения или аппликации раствора Na2HP32O4 на поверхность зуба. В настоящее время установлено, что в эмаль зуба из слюны проникают многие неорганические ионы, причем некоторые и.ч них обладают высокой степенью проникновения. Так, при нанесении раствора радиоактивного йодида калия на поверхность интактных клыков кошки он через 2 ч был обнаружен в щитовидной железе. В настоящее время изучены некоторые закономерности этого важного для эмали явления. Установлено, что уровень ее проницаемости может изменяться под воздействием ряда факторов. Так, этот показатель снижается с возрастом. Электрофорез, ультразвуковые волны, низкое значение рН усиливают проницаемость эмали. Она увеличивается также под воздействием фермента гиалуронидазы, количество которой в полости рта увеличивается при наличии микроорганизмов, зубного налета. Еще более выраженное изменение проницаемости эмали наблюдается, если к зубному налету имеет доступ сахароза. В значительной мере степень поступления ионов в эмаль зависит от их характеристик. Одновалентные ионы обладают большей проникающей способностью, чем двухвалентные. Важное значение имеют заряд иона, рН среды, активность ферментов и др. Особого внимания заслуживает изучение распространения в эмали ионов фтора. При аппликации раствора фторида натрия ионы фтора быстро поступают на небольшую глубину (несколько десятков микрометров) и, как считают некоторые авторы, включаются в кристаллическую решетку эмали. Следует отметить, что после обработки поверхности эмали раствором фторида натрия ее проницаемость резко снижается. Этот фактор имеет важное значение для клинической практики, так как определяет последовательность обработки зуба в процессе реминерализующей терапии. Такое выражение широко распространено в зарубежной литературе и меньше — в нашей. Под созреванием подразумевается увеличение содержания кальция, фосфора, фтора и других компонентов и совершенствование структуры эмали зуба. Поводом для изучения этого вопроса послужили многочисленные наблюдения изменения зубов и, особенно, эмали после их прорезывания. В настоящее время установлено, что в эмали после прорезывания зуба происходит накопление кальция и фосфора, наиболее активно — в первый год после прорезывания зуба, когда кальций и фосфор адсорбируются во всех слоях различных зон эмали. В дальнейшем накопление фосфора, а после 3-летнего возраста — кальция, резко замедляется. По мере созревания эмали и увеличения содержания минеральных компонентов растворимость поверхностного слоя эмали, по показателям выхода в биоптат кальция и фосфора, снижается. Установлена обратная зависимость между содержанием кальция и фосфора в эмали и степенью поражения кариесом. Поверхность зуба, где эмаль содержит больше кальция и фосфора, значительно реже поражается кариесом, чем поверхность зуба, эмаль которого содержит меньшее количество этих веществ. В созревании эмали важная роль принадлежит фтору, количество которого после прорезывания зуба постепенно увеличивается. Добавочное введение фтора снижает растворимость эмали и повышает ее твердость. Из других микроэлементов, влияющих на созревание эмали, следует указать на ванадий, молибден, стронций. Механизм созревания эмали изучен недостаточно. Считают, что при этом происходят изменения в кристалличгской решетке, уменьшается объем микропространств в вмали, что приводит к увеличению ее плотности. Данные Растворимость эмали — одно из важных, присущих этой самой минерализованной ткани человеческого организма свойств. В нормальных естественных условиях полости рта растворимость эмали проявляется лишь в незначительной степени, так как основное качество эмали как биологической ткани — устойчивость ее к постоянному действию различных факторов. Находясь на границе соприкосновения с внешней средой, эмаль все время подвергается сильному воздействию разнообразных факторов: микрофлоры, колебанию температуры, химических веществ, механической нагрузки и др. Сохранение ее свойств и структуры возможно лишь в условиях поддержания постоянного динамического равновесия эмали со слюной в результате физико-химического обмена ее компонентов с этой биологической жидкостью. 7.Взаимосвязь обменов жиров и углеводов:
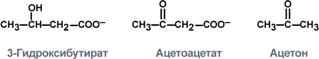
Строение кетоновых тел
Кетоацидоз развивается при уменьшении концентрации инсулина крови, существенном недостатке углеводов в пище при достаточном или избыточном потреблении белков и жиров, при отравлении алкоголем, при голодании. Механизм развития кетоацидоза состоит в избыточном окислении жирных кислот, поступающих в печень с пищей или из жировой ткани (активация липолиза) либо недостаточно эффективное сжигание "алкогольного" ацетил-SКоА. Кетонемия (повышение концентрации кетоновых тел в крови) возникает при нарушении равновесия — скорость синтеза кетоновых тел превышает скорость их утилизации периферическими тканями организма. Кетонурия Повышенное выведение кетоновых тел с мочой; наблюдается при сахарном диабете, отравлениях ацетоном, голодании Диабетический кетоацидоз (ДКА) обусловливается резкой недостаточностью регуляторного действия инсулина на обмен глюкозы и жира. При ДКА к эффектам высокой гипергликемии добавляются последствия увеличения печеночного синтеза и поступления в кровь кетоновых тел, так что количество их намного превышает потребность периферических тканей в энергии. Основные кетоновые тела - ацетоуксусная и Р-гидроксимасляная кислоты - являются сильными органическими кислотами; гиперкетонемия вызывает метаболический ацидоз с последующей дыхательной компенсацией, а резкое повышение экскреции с мочой ацетоуксусной и бета-гидроксимасляной кислот неизбежно приводит к дополнительным потерям Na и К.. В результате спонтанного декарбоксилирования ацетоуксусной кислоты в плазме накапливается ацетон, который медленно выводится из организма через дыхательные пути. Уровень свободных жирных кислот в плазме и их поступление в печень резко увеличиваются. В норме инсулин регулирует окисление свободных жирных кислот и кетогенез в печени за счет непрямого торможения транспорта КоА-производных длинноцепочечных жирных кислот через внутреннюю мембрану митохондрий в их матрикс. Эти производные, попав в митохондриальный матрикс, быстро окисляются, а повышение скорости их окисления в печени сверх определенного предела автоматически приводит к увеличению и высвобождению ацетоуксусной кислоты; большая, но непостоянная часть последней перед выходом в плазму восстанавливается до бета-гидроксимасляной кислоты. Глюкагон стимулирует транспорт ацил-КоА-производных длинноцепочечных жирных кислот и их окисление и кетогенез в митохондриях печени, а нормальный противодействующий эффект инсулина при ДКА отсутствует. Соотношение p-гидроксимасляной и ацетоуксусной кислот, в норме составляющее 3:1, при ДКА резко возрастает, достигая иногда 8:1. Синтез гема Синтез гема в основном идет в предшественниках эритроцитов, клетках печени, почек, слизистой кишечника, и в остальных тканях.
Протопорфирин IX связывания с железом образует гем Достаточное количество ионов железа оказывает положительный эффект при синтезе молекулы аминолевулинатсинтазы. В клетке имеется особый железосвязывающий белок, который в отсутствии ионов железа обладает сродством к мРНК фермента и блокирует ее трансляцию в рибосоме, т.е. синтез белковой цепи. Ионы железа связываются с этим железосвязывающим белком, образуя с ним неактивный комплекс, что инициирует синтез фермента. Метаболизм железа всасывание происходит в проксимальном отделе тонкого кишечника в количестве около 1,0-2,0 мг/день (10-15% пищевого железа). При этом железо должно быть в виде двухвалентного иона, в то же время с пищей поступает преимущественно трехвалентное железо. Для восстановления Fe3+ в Fe2+ используется аскорбиновая кислота и соляная кислота. После всасывания железо либо откладывается в клетках кишечника в составе ферритина (Fe3+), либо сразу попадает в кровоток и в комплексе с трансферрином (Fe3+) переносится в клетки печени, костного мозга или других тканей, где также связывается с ферритином. Вне связи с белками железо очень токсично, так как запускает свободно-радикальные реакции с образованием активных форм кислорода.
Гемоглобин(Гем)
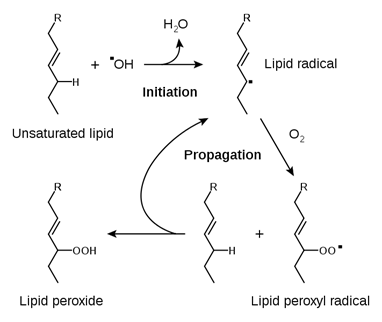
Миоглоби́н — кислород-связывающий белок скелетных мышц и мышцы сердца. Цитохром- содержит ковалентно связанный гем, расположенный во внутреннем кармане, образованном аминокислотными остатками. Цитохромы присутствуют во всех клетках организмов. В клетках эукариот они локализованы в митохондриальных мембранах Каталаза-фермент, который разлагает образующуюся в процессе биологического окисления перекись водорода на воду и молекулярный кислород (2H2O2 → 2H2O + O2), а также окисляет в присутствии перекиси водорода низкомолекулярные спирты и нитриты. Участвует в тканевом дыхании. Относится к хромопротеидам, имеющим в качестве простетической (небелковой) группы окисленный гем. 10.Процесс перекисного окисления липидов (ПОЛ) является важной причиной накопления клеточных дефектов. Основным субстратом ПОЛ являются полиненасыщенные цепи жирных кислот (ПНЖК), входящих в состав клеточных мембран, а также липопротеинов. Их атака кислородными радикалами (АФК) приводит к образованию гидрофобных радикалов, взаимодействующих друг с другом. Вначале происходит атака сопряженных двойных связей ненасыщенных жирных кислот со стороны НО* и НО2*, что приводит к появлению липидных радикалов. Липидный радикал может реагировать с О2 с образованием пероксильного радикала, который, в свою очередь, взаимодействует с новыми молекулами ненасыщенных жирных кислот и приводит к появлению липидных пероксидов, которые достаточно стабильны при температуре тела.Скорость этих реакций зависит от активности антиоксидантной системы клетки. При взаимодействии с комплексами железа гидроперекиси липидов превращаются в активные радикалы, продолжающие цепь окисления липидов: LOOH + Fe2+ Fe(III) + OH- + LO* LO* + LH LOH + L*. Образующиеся липидные радикалы, а также 4-гидроксиноненаль и МДА, могут атаковать молекулы белков и нуклеиновых кислот. Альдегидные группы этих соединений образуют межмолекулярные сшивки, что сопровождается нарушением структуры макромолекул и дезорганизует их функционирование (Aruoma, 1998). Окисление липидов приводит к нарушению нормальной упаковки мембранного бислоя, что может вызвать повреждение и мембраносвязанных белков. Так, например, ПОЛ может приводить к инактивации мембранных рецепторов, а также таких ферментов, как глюкозо- 6-фосфатаза и Na/K-АТФаза, принимающая непосредственное участие в поддержании ионного гомеостаза клетки. В митохондриях могут повреждаться как ферменты матрикса, так и компоненты дыхательной цепи. Поврежденные мембраны утрачивают энергетический потенциал, электровозбудимую функцию, контроль за ионными потоками и медиаторными системами, возникают патологические (воспалительные, нейродегенеративные, злокачественные) изменения в тканях, что, в конце концов, приводит организм к гибели. Пероксинитрит, индуцирует процессы ПОЛ в мембранах липопротеинах сыворотки крови, что усиливает их захват макрофагами и лежит в основе атерогенеза.
Прооксиданты Окисление углеводородов, спиртов, кислот, жиров и др. кислородом воздуха представляет собой цепной процесс. Цепные реакции превращений осуществляются с участием активных свободных радикалов — перекисных (RO2*), алкоксильных (RO*), алкильных (R*), а также активных форм кислорода (супероксид анион, синглетный кислород). Для цепных разветвлённых реакций окисления характерно увеличение скорости в ходе превращения (автокатализ). Это связано с образованием свободных радикалов при распаде промежуточных продуктов — гидроперекисей и др. Механизм действия наиболее распространённых антиоксидантов (ароматические амины, фенолы, нафтолы и др.) состоит в обрыве реакционных цепей: молекулы антиоксиданта взаимодействуют с активными радикалами с образованием малоактивных радикалов В полости рта Антиоксидантные витамины E и C наряду с каротиноидами (напр. бета-каротин), снижают активность оксидативного стресса в клетках и тканях организма. Они усиливают иммунную защиту десен и предупреждают инвазию микробов в слизистую ротовой полости. Исследования выявили зависимость между низким уровнем антиоксидантов в сыворотке крови и увеличением встречаемости периодонтита (12, 13). Недостаточное содержание витамина C повышает риск повреждения десен и периодонтального связочного аппарата. Соответственно, адекватное поступление витамина C в организм может предупредить развитие этих нарушений (14, 15). Одно из типичных проявлений тяжелого гиповитаминоза C - это цинга; при недостаточности витамина C не редко развивается гингивит (повышенная кровоточивость десен).
Витамины Биотин (витамин Н) - принимает участие в обмене жирных кислот и переносе в организме углекисл
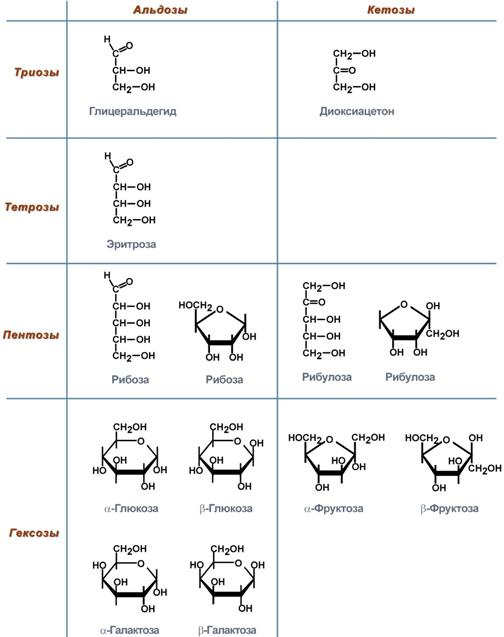
12. Моносахариды – это углеводы, которые не могут быть гидролизованы до более простых форм углеводов. Дисахариды Сахароза – пищевой сахар, в которой остатки глюкозы и фруктозы связаны α1,2-гликозидной связью. В наибольшем количестве содержится в сахарной свекле и тростнике, моркови, ананасах, сорго. Мальтоза – продукт гидролиза крахмала и гликогена, два остатка глюкозы связаны α1,4-гликозидной связью, содержится в солоде, проростках злаков. Лактоза – молочный сахар, остаток галактозы связан с глюкозой β1,4-гликозидной связью, содержится в молоке. В некоторых ситуациях (например, беременность) может появляться в моче. Целлобиоза – промежуточный продукт гидролиза целлюлозы в кишечнике, в котором остатки глюкозы связаны β1,4-гликозидной связью. Здоровая микрофлора кишечника способна гидролизовать до 3/4 поступающей сюда целлюлозы до свободной глюкозы, которая либо потребляется самими микроорганизмами, либо всасывается в кровь.
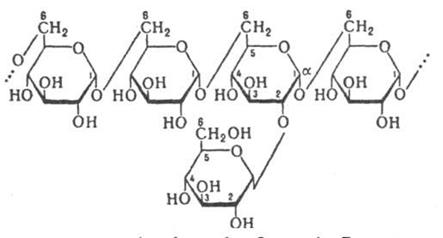
Крахмал – гомополимер α-D-глюкозы. Находится в злаках, бобовых, картофеле и некоторых других овощах. Синтезировать крахмал способны почти все растения. Биосинтез зубного налета Биосинтез декстранов осуществляется путем расщепления сахарозы с послед. переносом остатка глюкозы на акцептор, к-рым м. б. сахароза или растущая цепь декстрана. Р-ция катализируется ферментом декстрансахаразой.
При участии ферментов бактерий зубного налета, из глюкозы синтезируются полимеры — декстран, из фруктозы — леван. Последоват. присоединение остатков -D-фруктофуранозы, к фруктозному остатку 6-кестозы дает леван (в бактериях). Биосинтез муреина. Его первой стадией является синтез характеристичного моносахарида. Вначале в цитоплазме из Тчацетилглюкозамин-1-фосфата и УТФ образуется уридин-N-ацетилглюкозамин. Затем в положение 3 этого нуклеотида (в две стадии) присоединяется остаток молочной кислоты и образуется уридиндифосфо-Ы-ацетилмураминовая кислота [ацетилмураминовая кислота — сахар, встречающийся только в клеточной стенке прокариот]. К ней присоединяются пять аминокислотных остатков, причем концевой всегда является napa-D-аланил-О-аланин.
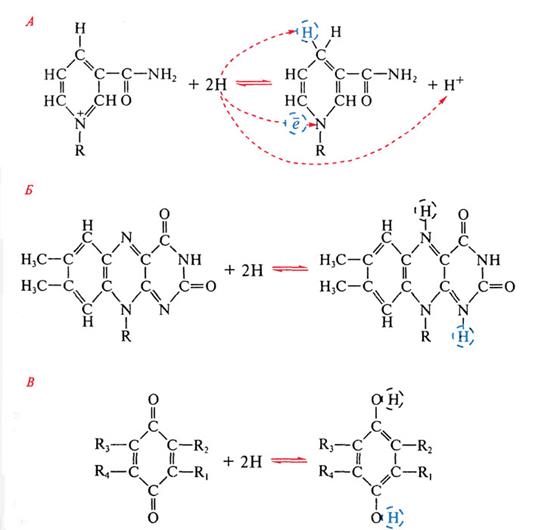
13.НАД(Ф) -зависимые дегидрогеназы, катализирующие протоны водорода от молекул различных субстратов и передающие его на стартовый переносчик дыхательной цепи - НАД(Ф)*Н2-дегидрогеназу, - растворимые ферменты. Дегидрогеназы флавопротеиновой природы, выполняющие аналогичную функцию, могут быть локализованными в мембране (например, сукцинатдегидрогеназа) или существовать в растворимой форме (ацетил-КоA-дегидрогеназы жирных кислот). Водород с них поступает в дыхательную цепь на уровне хинонов. Известно более 250 НАД(Ф)-зависимых дегидрогеназ, активно участвующих в реакциях промежуточного обмена. Но не все из них имеют отношение к энергетическому метаболизму. С помощью дегидрогеназ осуществляется перенос гидрид-иона (2е + Н+ переходит в Н-) от субстрата к НАД(Ф), при этом в среду переходит протон (рис. 93, А).
Атом водорода входит в состав пиридинового кольца, а электрон присоединяется к азоту пиридинового кольца. После восстановления НАД(Ф)*Н2 отщепляется от активного центра фермента и переносится к мембране, где акцептируется флавиновой дегидрогеназой и передает ей восстановительные эквиваленты. Одновременно к дегидрогеназе, освобожденной от кофермента, присоединяется окисленная молекула НАД(Ф), поступающая из среды. Таким образом, особенность НАД(Ф) - их подвижность, позволяющая им курсировать от молекул-доноров электронов, находящихся в цитоплазме, к акцепторам электронов, локализованным в мембране.
В состав флавиновых дегидрогеназ входят флавиновые нуклеотиды, прочно связанные с апоферментом и не отщепляющиеся от него ни на одной стадии каталитического цикла. Окислительно-восстановительные свойства флавопротеинов обусловлены способностью изоаллоксазинового кольца рибофлавина к обратимому переходу из окисленного состояния в восстановленное, при котором происходит присоединение к кольцу 2 электронов в составе атомов водорода (рис. 93, Б). При изучении дыхательных цепей особенно интересны два связанных с мембраной флавопротеина: сукцинатдегидрогеназа, катализирующая окисление сукцината в ЦТК, и НАД(Ф)*Н2-дегидрогеназа, катализирующая восстановление своей флавиновой простетической группы, сопряженное с окислением НАД(Ф)*Н2. Участие в дыхательном электронном транспорте принимают белки, содержащие железосероцентры (рис. 58).
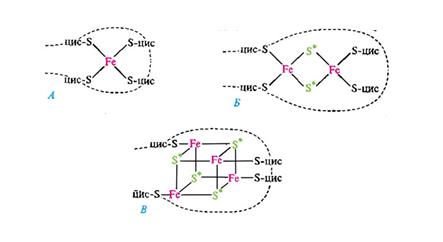
Железосероцентры FeS-белков. Железосероцентр рубредоксина (А); предполагаемые модели железосероцентров Fe2S2-THna (Б) и Fe4S4-типа (В).
Звездочкой отмечена неорганическая кислотолабильная сера; прерывистой линией обозначена полипептидная цепь; цис - цистеин. О
|
|||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-08-16; просмотров: 1317; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.224.62.238 (0.012 с.) |












 способный обратимо связываться с кислородом, обеспечивая его перенос в ткани
способный обратимо связываться с кислородом, обеспечивая его перенос в ткани