
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Окислительное декарбоксилирование пируватаСодержание книги
Поиск на нашем сайте
1-ю реакцию катализирует фермент ПИРУВАТДЕКАРБОКСИЛАЗА (Е1).
2-ю и 3-ю реакцию процесса катализирует фермент АЦИЛТРАНСФЕРАЗА (Е2).
3 этап - продолжает работать фермент ацилтрансфераза.
Второй фермент данного комплекса является не только ацетилтрансферазой, но и окислительным ферментом одновременно (дегидрогенизирующая ацетилтрансфераза). Энергия этого окисления аккумулируется в виде макроэргической связи активной формы уксусной кислоты (ацетил-КоА).
4 этап катализируется ферментом ДИГИДРОЛИПОИЛДЕГИДРОГЕНАЗОЙ.
В итоге можем записать суммарное уравнение:
Аналогично действует ферментный комплекс для окислительного декарбоксилирования a-кетоглутарата. Но названия двух из трех ферментов другие: 1-й фермент - декарбоксилаза a-кетоглутаровой кислоты 2-й фермент - сукцинилтрансфераза (переносит остаток янтарной кислоты)
Суммарное уравнение для этого комплекса:
В результате действия этих двух комплексов, каждый из двух приведенных субстратов (ПВК и a-КГ) - теряют СО2, два протона и два электрона, которые передаются на кислород с образованием Н2О и параллельно происходит фосфорилирование трех молекул АТФ. Сами субстраты превращаются в итоге в активную форму соответствующей кислоты. Макроэргическая связь в молекулах этих активных форм может легко трансформироваться в макроэргическую связь молекулы АТФ. Например, для молекулы сукцинил-КоА:
Такой способ образования АТФ, когда нет сопряжения с процессами окисления, называется СУБСТРАТНЫМ ФОСФОРИЛИРОВАНИЕМ (при этом используется макроэргическая связь в молекуле какого-нибудь субстрата).
ЭНЕРГЕТИЧЕСКИЙ ИТОГ УДЛИНЕННОЙ ЦЕПИ. Образуются 3 молекулы АТФ путем окислительного фосфорилирования. Продукты окислительного декарбоксилирования (ацетил-КоА и сукцинил-КоА) содержат макроэргическую связь. Энергия макроэргической связи сукцинил-КоА используется двумя способами. 1) Субстратное фосфорилирование в ЦТК (так расходуется большая часть этого вещества). 2) Реакции синтеза гема (меньшая часть сукцинил-КоА). Энергия макроэргической связи Ацетил-КоА используется только в реакциях синтеза: а) Синтез лимонной кислоты (цитрата). б) Синтез кетоновых тел
в) Синтез жирных кислот г) Синтез холестерина
Среди субстратов МтО почти нет веществ, которые организм получает с пищей - только глутаминовая кислота. Субстраты МтО - в основном органические кислоты, которые образуются в организме в процессе катаболизма. В процессе катаболизма из большого количества разнообразных пищевых веществ образуется всего 2 вида общих метаболитов: Ацетил-КоА и ПВК.
Трансаминирование.При добавлении к гомогенату мышц глутаминовой и пиро-виноградной кислот образуются α-кетоглутаровая кислота и аланин без промежуточного свободного аммиака; добавление аланина и α-кетоглу-таровой кислоты приводило к образованию соответственно пировиноград-ной и глутаминовой кислот. Иными словами, предшественниками глюкозы вглюконеогенезе может быть пируват или любое соединение, превращающееся в процессе катаболизма в пируват или один из промежуточных продуктов цикла трикарбоновых кислот. У позвоночных наиболее интенсивно глюконеогенез протекает в клетках печени и почек (в корковом веществе). Большинство стадий глюконеогенеза представляет собой обращение реакции гликолиза. Только 3 реакциигликолиза (гексокиназная, фосфо-фруктокиназная и пируваткиназная) необратимы, поэтому в процесс глю-конеогенеза на 3 этапах используются другие ферменты. Рассмотрим путь синтеза глюкозы из пирувата.
Глюконеогенез – синтез глюкозы из неуглеводных продуктов. Такими продуктами или метаболитамиявляются в первую очередь молочная и пи-ровиноградная кислоты Образование фосфоенолпирувата из пирувата.
ТИАМИН (витамин Bt), водорастворимый витамин группы В. Существует в виде солей, важнейшая из к-рых тиамин-гидрохлорид Соли тиамина хорошо раств. вводе, хуже в спиртах, не раств. в эфире, хлороформе, бензоле и ацетоне. Потребность человека в тиамине составляет. 0,5 мг на 1000 ккал (4186 кДж) суточного рациона или от 1,5 до 2,5 мг/сут в зависимости от энергозатрат. Тиамин широко распространен в живой природе. Синтезируется растениями и мн. микроорганизмами. Животные и человек не синтезируют тиамин и должны получать его с пищей. ТДФ-зависимая пируватдегидрогеназа принимает участие в окислит. декарбоксилировании пировиноградной к-ты (пирувата) с образованием ацетилкофермента А. Недостаток тиамина в организме ведет к накоплению в крови и тканях недоокисленных продуктов обмена в-в, что, в свою очередь, приводит к патофизиол. и патоморфологич. изменениям, создающим картину В1-авитаминоза, одной из форм к-рого является болезнь бери-бери (полиневрит, сердечно-сосудистые расстройства, отеки и др.).
ПАНТОТЕНОВАЯ КИСЛОТА
Пантотеновая кислота по хим. св-вам - типичный представитель гидрокси-кислот, может образовывать разл. производные как по карбоксильной группе (сложные эфиры, амиды, хлорангид-рид, азид, соли), так и по гидроксильной группе (сложные и простые эфиры). Витамин синтезируется зелеными растениями, микроорганизмами, в т.ч. микрофлорой млекопитающих (авитаминозы, связанные с отсутствием пантотеновой кислоты, у человека поэтому обычно не наблюдаются). Особенно богаты пантотеновой кислотой печень (7-11 мг в 100 г) и почки (3,4-4,7 мг) высших животных, эмбриональные клетки (желток 2,7-7,0 мг), злаки (1,0-2,6 мг). В процессе хранения продуктов и их обработки потери витамина составляют 25-50%. Потребность в пантотеновой кислоте у высших животных составляет 0,1-2,5 мг/кг массы. Признаки дефицита пантотеновой кислоты у человека неспецифичны. У животных отмечается задержка роста, дерматит, выпадение шерсти, поражение желудочно-кишечного тракта, адреналовой системы (вырабатывает и выделяет в кровь катехолами-ны) и др. Пантотеновая кислота в виде КоА участвует в углеводном и жировом обмене, в синтезе ацетилхолина, в коре надпочечников стимулирует образование кортикостероидов. • Пируват входит в органический состав слюны. Полоскание полости рта чаем, содовым раствором или чистка зубов щеткой позволяют существенно снизить концентрацию глюкозы и ее метаболитов (пирувата, лактата и др.) в смешанной слюне человека после приема сладостей.
21. Особенности синтеза коллагена. Внутри- и внеклеточные этапы процесса образования «зрелого» коллагена, строение сшивок, центры минерализации. Участие витамина С в синтезе коллагена и другие биохимические функции аскорбата, суточная потребность и признаки недостаточности. Биохимические маркеры синтеза и распада коллагена.Синтез коллагена На примере коллагена –I: характерен для кости, является основным белком дентина. (закрепляем материал по посттрансляционному процессингу белка и микросомальному окислению) Коллаген синтезируется в фибробластах в виде высокомолекулярного предшественника – проколлагена. На этапах синтеза коллагена после включения пролина и лизина в полипептидную цепь происходит их гидроксилирование (специфично для молекулы коллагена). Образование гидроксипролила и гидроксилизила катализируют железосодержащие ферменты — пролингидроксилаза и лизингидроксилаза, их кофактор — аскорбиновая кислота. Гидроксилирование аминокислот является диоксигеназной реакцией, т.е. молекула кислорода одновременно окисляет два субстрата (аминокислоту и a-кетоглутарат):
В результате реакции образуются оксипролин и сукцинат (в молекулу которого включён второй атом кислорода из молекулы О2) и выделяется СО2. Реакция высокоспецифична – остатки пролина и лизина подвергаются гидроксилированию, если они расположены со стороны аминогруппы глицинового остатка. Аскорбиновая кислота работает как восстановительный агент, благодаря которому железо в активном центре фермента сохраняется в форме Fe2+. При недостатке витамина С синтез коллагена нарушается, возникает непрочность коллагеновых волокон, кровоточивость десен, расшатывание зубов (проявления цинги). Расшатывание зубов обусловлено, главным образом, недогидроксилированием вновь синтезированного коллагена периодонтальной связки. Такой коллаген плохо агрегирует.
К остаткам гидроксилизина под действием сначала галактозилтрансферазы, затем глюкозилтрансферазы присоединяются углеводные единицы (в основном остается одна галактоза или дисахарид, состоящий из галактозы и глюкозы). Гидроксилирование и трансферазная реакция происходят во вновь синтезированном коллагене, ещё не претерпевшем спирализации в просвете эндоплазматического ретикулюма. Затем каждая про-a-цепь с помощью водородных связей объединяется с двумя другими в молекулу проколлагена, которая секретируется в межклеточный матрикс. • Проколлаген имеет более длинные цепи, чем тропоколлаген. Дополнительные концевые фрагменты не образуют обычную трехцепочечную спираль, а объединяются друг с другом в глобулярные домены, структура которых совершенно не похожа на уникальную линейную структуру зрелого коллагена. Это препятствует агрегации и образованию фибрилл внутриклеточно, что было бы фатальным для клетки. После того как во внеклеточном пространстве сформировались коллагеновые фибрилы, их прочность существенно увеличивается, так как образуются ковалентные сшивки между остатками лизина внутри и между молекулами тропоколлагена, укрепляя четвертичную структуру.
II этап. Альдегидные группы самопроизвольно взаимодействуют друг с другом, образуя альдольные поперечные связи коллагена, или реагируют с аминогруппой остатков лизина или 5-гидроксилизина (рис. А), обеспечивая образование бифункциональных ковалентных сшивок между соседними молекулами тропоколлагена.
Если в реакции участвует аллизин, то она протекает по механизму альдиминной конденсации. При этом по иминной связи промежуточного соединения присоединяются 2 атома Н. В результате образуются сшивки с группировкой -NH- в середине – лизиннорлейцин или гидроксилизиннорлейцин (рис. А).
Присутствие гидроксильной группы в 5 положении гидроксиаллизина предопределяет течение реакции по механизму кетоиминной конденсации (рис Б). В этом случае в цепи получившейся поперечной сшивки лизино-5-кетонорлейцина или гидроксилизино-5-кетонорлейцина вместе с группировкой -NH- присутствует кето-группа. Цепочки таких перемычек достаточно длинные, чтобы иметь некоторую гибкость, а ковалентное соединение атомов придаёт им высокую прочность и закрепляет регулярную структуру микрофибрилл коллагена. Поперечные бифункциональные сшивки имеют свой вариант упорядоченности: каждый концевой телопептид тропоколлагена соединён перемычкой с расположенным на том же уровне участком смежной молекулы (рис. 9). Подобная локализация и прочность сшивок позволяет обнаружить их в составе N- и C-телопептидов, отщепляемых при распаде коллагена (для идентификации таких специфичных фрагментов разработаны методы, основанные на иммуноферментном анализе).
Бифункциональные связки наиболее присущи фибриллообразующим коллагенам типа I, II и III, причём в зависимости от вида ткани преобладает какой-либо определённый вид сшивки. III этап. По мере созревания ткани возникают перемычки и между микрофибриллами. В бифункциональных сшивках сохраняются реакционноспособные атомы, которые постепенно вступают в реакции дополнительной конденсации с образованием трифункциональных сшивок, имеющих в центре гетероцикл – пиридиниевое или пиррольное кольцо (рис. В, Г). Эти процессы протекают также неферментативно путём спонтанного взаимодействия кетоиминной двойной сшивки одной микрофибриллы с альдегидным радикалом, расположенным в телопептидной части другой микрофибриллы. Если в реакции участвуют 5-гидроксиаллизин и уже сформированная сшивка гидроксилизино-5-кетонорлейцина, то продуктом становится гидроксилизил-пиридинолин (рис. В). Это главная трифункциональная сшивка коллагенов большинства тканей. В минерализуемых тканях (кость, дентин зуба) число пиридиниевых сшивок в 5-10 раз меньше, чем в хряще и сухожилиях, причём чаще всего здесь встречается лизил-пиридинолин – вариант с негидроксилированной цепочкой в перемычке, образованной с участием лизино-5-кетонорлейцина.
Более того, для минерализованных тканей (кость, ткани зуба) характерны сшивки пиррольного типа, которые образует негидроксилированный аллизин, соединяясь с бифункциональной сшивкой гидроксилизино-5-кетонорлейцином (рис. Г). Из всех трифункциональных перемычек именно гидроксилизилпиррол специфичен для минерализуемых тканей. Дополнительные перемычки циклического характера увеличивают прочность коллагена. Образование разнообразных сшивок обеспечивает механическую прочность волокон коллагена. Остатки лизина и 5-гидроксилизина подвергаются окислению постепенно, поэтому количество поперечных связей между отдельными молекулами тропоколлагена, соседними микрофибриллами и пучками волокон с течением времени увеличивается, прочность коллагена возрастает: идёт процесс его «созревания».
Учитывая роль ЛИЗ в организации различных вариантов ковалентных сшивок в коллагеновой матрице костной ткани, зубного дентина и цемента становится понятной материальная основа применения лизина как средства, предотвращающего заболевания зубов.
|
|||||||||||||
|
Последнее изменение этой страницы: 2016-08-16; просмотров: 786; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.119.135.208 (0.012 с.) |

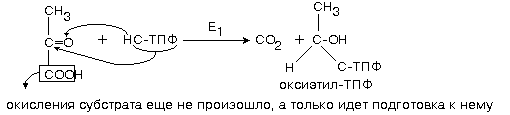



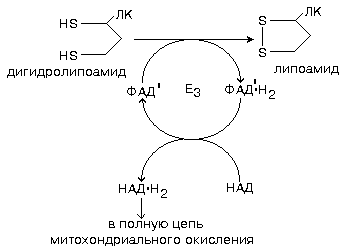






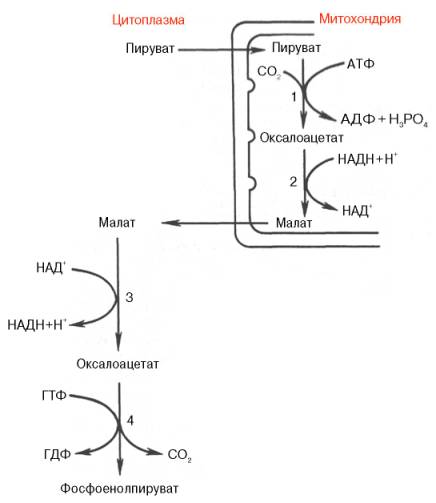

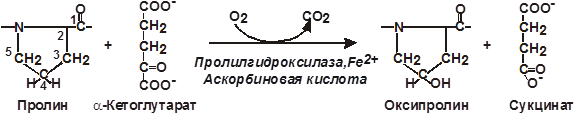

 РИС А
РИС А РИС Б
РИС Б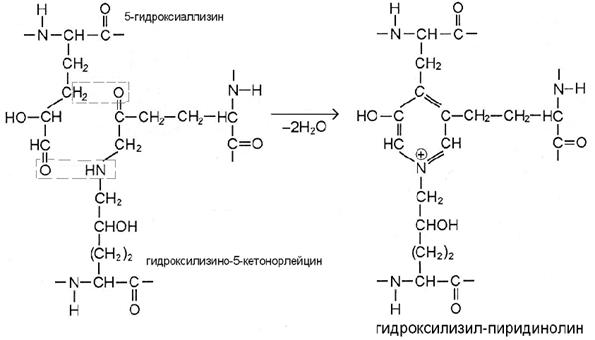 В
В Г
Г


