
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Что такое внутреннее давление жидкости. Как зависит поверхностное натяжения от концентрации раствора.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Колобок 4 Химия 1. ПОВЕРХНОСТНОЕ НАТЯЖЕНИЕ, стремление в-ва (жидкости или твердой фазы) уменьшить избыток своей потенциальной энергии на границе раздела с др. фазой (поверхностную энергию). Определяется как работа, затрачиваемая на создание единицы площади пов-сти раздела фаз (размерность Дж/м2). Согласно др. определению, поверхностное натяжение-сила, отнесенная к единице длины контура, ограничивающего пов-сть раздела фаз (размерность Н/м); эта сила действует тангенциально к пов-сти и препятствует ее самопроизвольному увеличению. Поверхностное натяжение-осн. термодинамич. характеристика поверхностного слоя жидкости на границе с газовой фазой или др. жидкостью. Поверхностное натяжение разл. жидкостей на границе с собств. паром изменяется в широких пределах: от единиц для сжиженных низкокипящих газов до неск. тыс. мН/м для расплавл. тугоплавких в-в. Поверхностное натяжение зависит от т-ры. Для мн. однокомпо-нентных неассоциир. жидкостей (вода, расплавы солей, жидкие металлы) вдали от критич. т-ры хорошо выполняется линейная зависимость:
где s и s0-поверхностное натяжение при т-рах T и T0 соотв., a0,1 мН/(м·К)-температурный коэффициент поверхностного натяжения. Осн. способ регулирования поверхностного натяжения заключается в использовании поверхностно-активных веществ (ПАВ). 2. ПОВЕРХНОСТНОЕ НАТЯЖЕНИЕ, стремление в-ва (жидкости или твердой фазы) уменьшить избыток своей потенциальной энергии на границе раздела с др. фазой (поверхностную энергию). Определяется как работа, затрачиваемая на создание единицы площади пов-сти раздела фаз (размерность Дж/м2). Согласно др. определению, поверхностное натяжение-сила, отнесенная к единице длины контура, ограничивающего пов-сть раздела фаз (размерность Н/м); эта сила действует тангенциально к пов-сти и препятствует ее самопроизвольному увеличению. Поверхностное натяжение измеряется в эрг·см-2. Поверхностное натяжение-осн. термодинамич. характеристика поверхностного слоя жидкости на границе с газовой фазой или др. жидкостью. Поверхностное натяжение разл. жидкостей на границе с собств. паром изменяется в широких пределах: от единиц для сжиженных низкокипящих газов до неск. тыс. мН/м для расплавл. тугоплавких в-в. Поверхностное натяжение зависит от т-ры. Для мн. однокомпо-нентных неассоциир. жидкостей (вода, расплавы солей, жидкие металлы) вдали от критич. т-ры хорошо выполняется линейная зависимость:
где s и s0-поверхностное натяжение при т-рах T и T0 соотв., a0,1 мН/(м·К)-температурный коэффициент поверхностного натяжения. Осн. способ регулирования поверхностного натяжения заключается в использовании поверхностно-активных веществ (ПАВ). С увеличением температуры величина поверхностного натяжения уменьшается и становится нулем при увеличении температуры до критической. Наиболее известная зависимость поверхностного натяжения от температуры была предложена Лорандом Этвёшом, так называемое правило Этвёша (англ.). 3. Поверхностное натяжение может быть непосредственно измерено только в случае поверхности раздела жидкость — газ (насыщенный пар) или жидкость — жидкость. Для коллоидных растворов и растворов высокомолекулярных веществ это время значительно больше и измеряется иногда многими часами. В биохимических, физиологических и фармакологических исследованиях наиболее распространены следующие методы измерения поверхностного натяжения. 1. Сталагмометрический метод. Состоит в определении числа капель, образующихся при вытекании данного объема жидкости из капиллярного отверстия специальной пипетки — сталагмометра (рис. 1; 1— верхняя метка, 2— нижняя метка). Определив при помощи одного и того же сталагмометра число капель (n) исследуемой жидкости и число капель (n0) стандартной жидкости (обычно воды) с известным П. н. σ0, вычисляют П. н. исследуемой жидкости а по формуле: где d и d0 — уд. веса исследуемой и стандартной жидкости соответственно. 2. Метод продавливания пузырьков воздуха (предложен П. А. Ребиндером) основан на измерении давления р, необходимого для продавливания пузырька воздуха через капилляр, находящийся в соприкосновении с поверхностью исследуемой жидкости, и давления р0, необходимого для продавливания пузырька воздуха через тот же самый капилляр, находящийся в соприкосновении с поверхностью стандартной жидкости, поверхностное натяжение σ0 которой известно. П. н. исследуемой жидкости σ находят по уравнению: 4. Правило Дюкло-Траубе — зависимость, связывающая поверхностную активность водного раствора органического вещества с длиной углеводородного радикала в составе его молекулы. Согласно этому правилу, при увеличении длины углеводородного радикала на одну группу СΗ2 поверхностная активность вещества увеличивается в среднем в 3,2 раза[1]. Поверхностная активность зависит от строения молекул ПАВ; последние обычно состоят из полярной части (группы, обладающие большим дипольным моментом) и неполярной части (алифатические или ароматические радикалы). В границах гомологического ряда органических веществ, концентрация, необходимая для понижения поверхностного натяжения водного раствора до определённого уровня, снижается в 3-3,5 раза при увеличения углеродного радикала на одну -СΗ2-группу.В 1978 г. Дюкло и Траубе сформулировали эмпирическое правило: в гомологическом ряду поверхностно-активных веществ поверхностная активность и адсорбция возрастают при переходе к каждому последующему члену гомологического ряда примерно в 3,2 раза. Согласно правилу Дюкло — Траубе поверхностная активность веществ одного и того же гомологического ряда возрастает приблизительно в 3 раза при увеличении углеводородной цени на СН2-группу. Это правило справедливо для разбавленных растворов. В ряде случаев биологическая активность (например, наркотическое действие, бактерицидность и др.) веществ одного и того же гомологического ряда возрастает с увеличением их поверхностной активности в соответствии с правилом Дюкло — Траубе. 5. Адсорбция — накопление молекул или ионов на поверхности какого-либо тела. Примеры адсорбции: поглощение газов и веществ из растворов древесным углем, глиной. Если поглощаемое вещество (адсорбтив) химически реагирует с поглотителем (адсорбентом), процесс называют хемосорбцией. Адсорбцию используют в противогазах (см.) для очистки воздуха от вредных газов, для анализа сложных смесей (см. Хроматография), а также при лечении некоторых заболеваний желудочно-кишечного тракта (см. Активированный уголь). Процесс, обратный адсорбции, то есть перенос вещества с поверхности раздела фаз в объём фазы, называется десорбция. Абсорбция — растворение газа в жидкости или в твердом теле. На практике абсорбция чаще всего применяется для разделения смесей, состоящих из веществ, имеющих различную способность к поглощению подходящими абсорбентами. При этом целевыми продуктами могут быть как абсорбировавшиеся, так и не абсорбировавшиеся компоненты смесей. Сорбция — поглощение твердым телом либо жидкостью различных веществ из окружающей среды. Поглощаюемое вещество, находящееся в среде, называют сорбатом (сорбтивом), поглощающее твердое тело или жидкость - сорбатом. 6. Поверхностное натяжение (σ) - это поверхностная энергия Гиббса единицы поверхности (удельная энергия Гиббса). Она численно равна работе, затраченной на образование единицы поверхности. Единицы измерения σ: (Дж/м2) или (Н/м). Математически поверхностное натяжение есть частная производная энергии Гиббса (G) по величине поверхности (S) при постоянстве состава системы, давлении и температуры, т.е.
7. Хемосорбция, химическая сорбция, поглощение жидкостью или твёрдым телом веществ из окружающей среды, сопровождающееся образованием химических соединений. В более узком смысле хемосорбцию рассматривают как химическое поглощение вещества поверхностью твёрдого тела, т. е. как химическую адсорбцию. При химической сорбции (хемосорбции) между сорбентом и сорбатом возникает химическое взаимодействие, в результате чего между ними образуется третье вещество Химическая сорбция намного прочнее физической, десорбция самопроизвольно практически не происходит. Химическая адсорбция (хемосорбция) осуществляется путем химического взаимодействия молекул адсорбента и адсорбата. Хемосорбция обычно необратима; химическая адсорбция, в отличие от физической, является локализованной, т.е. молекулы адсорбата не могут перемещаться по поверхности адсорбента. Так как хемосорбция является химическим процессом, требующим энергии активации порядка 40 – 120 кДж/моль, повышение температуры способствует её протеканию. Примером химической адсорбции является адсорбция кислорода на вольфраме или серебре при высоких температурах. X. избирательна, т. к. зависит от хим. сродства адсорбированного в-ва к поверхности тв. тела. Играет большую роль в гетерогенном катализе, процессах очистки газов, вакуумной технике и т. д. 8. изотерма адсорбции — зависимость количества адсорбированного вещества (величины адсорбции) от парциального давления этого вещества в газовой фазе (или концентрации раствора) при постоянной температуре. Экспериментальные изотермы адсорбции являются наиболее распространенным способом описания адсорбционных явлений. Методы получения адсорбционных данных для построения изотерм адсорбции основаны на измерении количества газа (жидкости), удаленного из газовой (жидкой) фазы при адсорбции, а также на различных способах определения количества адсорбата (адсорбированное вещество) на поверхности адсорбента (адсорбирующее вещество), например, волюметрический метод, гравиметрический метод и др. Различают шесть основных типов изотерм адсорбции (см. рис.). Тип I характерен для микропористых твердых тел с относительно малой долей внешней поверхности. Тип II указывает на полимолекулярную адсорбцию на непористых или макропористых адсорбентах. Тип III характерен для непористых сорбентов с малой энергией взаимодействия адсорбент-адсорбат. Типы IV и V аналогичны типам II и III, но для пористых адсорбентов. Изотермы типа VI характерны для непористых адсорбентов с однородной поверхностью. Изотермы адсорбции используются для расчета удельной поверхности материалов, среднего размера пор или среднего размера нанесенных частиц, распределения пор или частиц по размерам. 9. Уравнение Фрейндлиха является эмпирическим уравнением. В случаях соответствия экспериментальным данным оно дает сжатое аналитическое выражение результатов опытов, но не может претендовать на сколько-нибудь исчерпывающее описание механизма адсорбции. Исторически оно является первым уравнением изотермы (поэтому его часто называют «классическим» уравнением) и до сих пор широко применяется исследователями, главным образом работающими в области промышленности Теоретические представления, развитые Ленгмюром и Поляни, в значительной степени идеализируют и упрощают истинную картину адсорбции. На самом деле поверхность адсорбента неоднородна, между адсорбированными частицами имеет место взаимодействие, активные центры не являются полностью независимыми друг от друга и т.д. Все это усложняет вид уравнения изотермы. Г. Фрейндлих показал, что при постоянной температуре число молей адсорбированного газа или растворенного вещества, приходящееся на единицу массы адсорбента (т.н. удельная адсорбция x/m), пропорционально равновесному давлению (для газа) или равновесной концентрации (для веществ, адсорбируемых из раствора) адсорбента, возведенным в некоторую степень, которая всегда меньше единицы: n Г = х/m= Kф * С
Х-кол-во вещ-ва адсорбтива (моль) m- масса адсорбента С – равновесная концентрация, при кот. v адсорбции = v десорбции Kф – константа Фрейндлиха, Kф = Г при С = 1 n – эмпирическая константа, 0,1 – 0,6 10. Теория мономолекулярной адсорбции, которую разработал американский химик И. Ленгмюр, основывается на следующих положениях. 1)Адсорбция является локализованной и вызывается силами, близкими к химическим. 2) Адсорбция происходит не на всей поверхности адсорбента, а на активных центрах, которыми являются выступы либо впадины на поверхности адсорбента, характеризующиеся наличием т.н. свободных валентностей. Активные центры считаются независимыми (т.е. один активный центр не влияет на адсорбционную способность других), и тождественными. 3) Каждый активный центр способен взаимодействовать только с одной молекулой адсорбата; в результате на поверхности может образоваться только один слой адсорбированных молекул. 4) Процесс адсорбции является обратимым и равновесным – адсорбированная молекула удерживается активным центром некоторое время, после чего десорбируется; т.о., через некоторое время между процессами адсорбции и десорбции устанавливается динамическое равновесие.
Уравнение Ленгмюра на всякий случай Г= Г(внизу значок «бесконечность»)С/(К+С) Для газов то же самое, только вместо С будет Р С- концентрация,Р- давление газа,К- константа адсорбционного равновесия К=К десорбции / К адсорбции 11. На практике часто (особенно при адсорбции паров) встречаются т.н. S-образные изотермы адсорбции, форма которых свидетельствует о возможном, начиная с некоторой величины давления, взаимодействии адсорбированных молекул с адсорбатом.
Для описания таких изотерм адсорбции М. Поляни предложил теорию полимолекулярной адсорбции, основанную на следующих основных положениях: 1. Адсорбция вызвана чисто физическими силами. 2. Поверхность адсорбента однородна, т.е. на ней нет активных центров; адсорбционные силы образуют непрерывное силовое поле вблизи поверхности адсорбента. 3. Адсорбционные силы действуют на расстоянии, большем размера молекулы адсорбата. Иначе говоря, у поверхности адсорбента существует некоторый адсорбционный объём, который при адсорбции заполняется молекулами адсорбата. 4. Притяжение молекулы адсорбата поверхностью адсорбента не зависит от наличия в адсорбционном объеме других молекул, вследствие чего возможна полимолекулярная адсорбция. 5. Адсорбционные силы не зависят от температуры и, следовательно, с изменением температуры адсорбционный объем не меняется. 12. Адсорбция электролитов не укладывается в рамки учения о молекулярной адсорбции, так как адсорбент может по-разному поглощать ионы, на которые распадаются молекулы электролита в растворе. Здесь может иметь место обменная адсорбция с образованием двойных электрических слоев. Это тонкий слой, образующийся на границе двух фаз из пространственно разделенных электрических зарядов противоположного знака. Такое разделение всегда сопровождается возникновением разности потенциалов? — электрохимического потенциала.
http://ilch.vsmu.edu.ua/students/medchem/rus/r_chromatogr.pdf Адсорбция электролитов, как правило, селективна. Ионы (катионы или анионы), избирательно сорбированные твердой поверхности, придают ей электрический заряд. Вследствие электростатического притяжения ионы противоположного знака образуют второй электрический слой. Адсорбция ионов зависит от их заряда, размеров и способности к сольватации (гидратации). Чем выше валентность иона, чем в большей мере он сорбируется. 13. Адсорбцию на границе раздела жидкость – газ непосредственно не измеряют,а вычисляют с помощью уравнения Гиббса, которое выведено на основании 2-го начала термодинамики: Г= -(d*сигма/dc)*(c/RT), Где Г- кол-во адсорбированного вещ-ва моль/см в квадрате с- молярная концентрация раствореного вещества, моль/дм в кубе R-газовая постоянная=8,32 дж/(моль*К) -(d*сигма/dc) – поверхностная активность
14 – 15 - WTF!? 16. Характерным признаком адсорбции яв-ся её избирательность или специфичность. Это значит, что каждый адсорбент адсорбирует не любые в-ва, а только одно или несколько определенных в-тв. Избирательность адсорбции объясняется тем, что должно произойти случайное совпадение в распределении электронной плотности молекул адсорбента и адсорбтива по типу «ключ – замок». Другими словами должно быть определенное химическое сродство между адсорбентом и адсорбтивом. Избирательность адсорбции яв-ся основой ее практического применения. При эквивалентной адсорбции адсорбируются ионы имеющие в своем составе адсорбенты. Объясняется это тем что адсорбируемые ионы включаются в его структуру и достраивают его. Эта закономерность сформулирована в виде правила Панета – Фаянса: при эквивалентной адсорбции адсорбируются те ионы, имеющие в своем составе такие же атомы или группировки как и в составе адсорбента. 17. Адсорбция растворенных вещ-в твердыми адсорбентами осложнена рядом факторов: · Присутствие третьего компонента – растворителя, молекулы которого могут конкурировать с молекулами адсорбата за места на молекуле адсорбента · Взаимодействие между молекулами адсорбента и растворителя · Электростатическое взаимодействие между поверхностью адсорбента и ионами адсорбата, если он является электролитом Неэлектролиты и слабые электролиты на поверхности адсорбента адсорбируются из растворов в виде молекул. Такой процесс наз-ся молекулярной адсорбцией. В рез-те ад-ции концентрация в растворе уменьшается. Ад-цию определяют по разности концентраций исходного и равновесного растаоров адсорбата: А=(с нулевое-с)V/m С нулевое-исх. Концентрация адсорбата С-равновесная …… Адсорбция зависит от природыи концентации адсорбента, температуры, природы адсорбента и растворителя, удельной поверхности адсорбента. Ребиндер сформулировал правило: на полярных адсорбентах лучше адорбируются полярные адсорбаты из малополярных растворителей; на неполярных адсорбентах – неполярные адсорбаты из полярных растворителей. Для сисетмы адсорбат-адсорбент влияние природы растворителя на адсорбцию сформулировано правило: Чем лучше в данном растворителе растворянтся данный адсорбат, тем хуже он адсорбируется и наоборот. Молекулы ПАВ при адсорбции на твердом адсорбенте ориентируются на его поверхности таким образом, чтобы полярная часть молекулы была обращена к полярной фазе, а неполярная – к неполярной. Так, при адсорбции алифатических карбоновых кислот из водных растворов на неполярном адсорбенте – активированном угле – молекулы ориентируются углеводородными радикалами к адсорбенту; при адсорбции из бензола (неполярный растворитель) на полярном адсорбенте – силикагеле – ориентация молекул кислоты будет обратной Адсорбция из водных растворов электролитов происходит, как правило, таким образом, что на твердом адсорбента из раствора адсорбируются преимущественно ионы одного вида. Преимущественная адсорбция из раствора или аниона, или катиона определяется природой адсорбента и ионов. Механизм адсорбции ионов из растворов электролитов может быть различным; выделяют обменную и специфическую адсорбцию ионов. Обменная адсорбция представляет собой процесс обмена ионов между раствором и твердой фазой, при котором твердая фаза поглощает из раствора ионы какого-либо знака (катионы либо анионы) и вместо них выделяет в раствор эквивалентное число других ионов того же знака. Обменная адсорбция всегда специфична, т.е. для данного адсорбента к обмену способны только определенные ионы; обменная адсорбция обычно необратима. При специфической адсорбции адсорбция на поверхности твердой фазы ионов какого-либо вида не сопровождается выделением в раствор эквивалентного числа других ионов того же знака; твердая фаза при этом приобретает электрический заряд. Это приводит к тому, что вблизи поверхности под действием сил электростатического притяжения группируется эквивалентное число ионов с противоположным зарядом, т.е. образуется двойной электрический слой. Взаимодействие концентрирующихся на поверхности зарядов приводит к понижению поверхностной энергии системы. Для случая специфической адсорбции электролита Песковым и Фаянсом было сформулировано следующее эмпирическое правило (правило Пескова – Фаянса): На поверхности кристаллического твердого тела из раствора электролита специфически адсорбируется ион, который способен достраивать его кристаллическую решетку или может образовывать с одним из ионов, входящим в состав кристалла, малорастворимое соединение. 18. Иониты — твердые нерастворимые вещества, способные обменивать свои ионы на ионы из окружающего их раствора. Обычно это синтетические органические смолы, имеющие кислотные или щелочные группы. Обычно это синтетические органические смолы, имеющие кислотные или щелочные группы. Иониты разделяются на катиониты, поглощающие катионы, и аниониты, поглощающие анионы. Широко применяются иониты для опреснения вод, в аналитической химии для разделения веществ методом хроматографии, в химической технологии. В зависимости от природы матрицы различают неорганические и органические иониты. Органические иониты — это в основном синтетические ионообменные смолы. Неорганические иониты — это в основном иониты природного происхождения, к которым относятся алюмосиликаты, гидроксиды и соли поливалентных металлов. По степени ионизации ионогенных групп иониты делят на сильно- и слабокислотные иониты и слабо- и сильноосновные аниониты. Сильнокислотные катиониты в качестве ионогенных групп содержат остатки серной, фосфорной и др. кислот. Слабокислотные – карбоксильные, сульфгидрильные и др. группы. Ионогенные группы сильнокислотных анионитов представляют собой обычно группы аммониевых. Или сульфониевых оснований, а слабоосновные – аминогруппы различной степени замещения, пиридиновые основания. Зерно катионита можно рассматривать как гигантский поливалентный анион, отделенные физической поверхностью раздела от окр. среды. Внутренняя часть такого поливалентного аниона пропитана раствором, содержащим большое кол-во водорода (или др. катионов), способных обмениваться на катионы, находящиеся в жидкости, окружающих зерно катиона. Зерно анионита можно рассматривать как гигантский поливалентный катион, противоионами которого являются гидроксильные ионы (или др. анионы), способные обмениваться на анионы 19. Если система гетерогенна, т.е. состоит по меньшей мере из двух фаз, то между фазами обязательно существует граница раздела. В наиболее общем случае мы имеем дело с поверхностью раздела двух фаз; на состав и свойства этой поверхности влияют любые изменения в любой из двух контактирующих фаз. Хотя мы и говорим «поверхность раздела», в действительности это всегда некоторый переходный слой конечной толщины. С течением времени после соприкосновения фаз будет происходить диффузия молекул каждой из фаз в другую, в результате чего постепенно будет достигнуто равновесное распределение компонентов в объемах контактирующих фаз и на межфазной границе. Однако, состояние вещества на межфазной границе отличается от его состояния в объеме фазы. Можно выделить следующие типы межфазной границы: жидкость-газ (ж/г), жидкость-жидкость (ж/ж), твердое тело-твердое тело (т/т), твердое тело-газ (т/г) и твердое тело-жидкость (т/ж). Чаще всего термин «поверхность» используется в случаях, когда одна из фаз газ или пар. Свойства пограничного слоя, естественно, зависят от свойств соприкасающихся фаз и в первую очередь от сил межмолекулярного притяжения. Больше ничего не нашла. надо поспрашивать ПАВ. Механизм действия. Поверхностно-активные вещества (ПАВ), вещества, адсорбция которых из жидкости на поверхности раздела с другой фазой (жидкой, твердой или газообразной) приводит к значит. понижению поверхностного натяжения (см. Поверхностная активность). В наиболее общем и важном с практической точки зрения случае адсорбирующиеся молекулы (ионы) ПАВ имеют дифильное строение, т. е. состоят из полярной группы и неполярного углеводородного радикала (дифильные молекулы). Поверхностной активностью в отношении неполярной фазы (газ, углеводородная жидкость, неполярная поверхность твердого тела) обладает углеводородный радикал, который выталкивается из полярной среды. В водном растворе ПАВ на границе с воздухом образуется адсорбционный мономолекулярный слой с углеводородными радикалами, ориентированными в сторону воздуха. По мере его насыщения молекулы (ионы) ПАВ, уплотняясь в поверхностном слое, располагаются перпендикулярно поверхности (нормальная ориентация).. ЗадачаПАВсостоит в том, чтобы прикрепить молекулы жира к молекулам воды. МолекулаПАВпредставляет собой сферу, один полюс которой - липофильный (соединяется с жирами), а другой - гидрофильный (вступает в связь с молекулами воды). То есть одним концом частицаПАВприкрепляется к частице жира, а другим концом - к частицам воды. 22.ПИВ.Механизм действия Смотрите в лекции начало!!!! Поверхностно-инактивные вещества стремятся уйти с поверхности жидкости в объем, в результате чего происходит отрицательная адсорбция. Поверхностно-инактивные вещества обладают поверхностным натяжением, большим поверхностного натяжения растворителя (иначе они самопроизвольно накапливались бы в поверхностном слое), и обычно высокой растворимостью, что способствует их стремлению уйти с поверхности в объем. Другими словами, взаимодействие между молекулами по-верхностно-инактивных веществ и растворителя всегда больше, чем взаимодействие между самими молекулами растворителя, поэтому поверхностно-инактивные вещества стремятся перейти в объем раствора. Поверхностно-инактивными веществами в отношении воды являются все неорганические электролиты — кислоты, щелочи, соли. Молекулы этих веществ не имеют гидрофобной части и распадаются в воде на хорошо гидратирующиеся ионы. Одновалентные ионы вызывают сравнительно небольшое повышение поверхностного натяжения. Двухвалентные ионы эффективнее одновалентных в эквимоляр-ных растворах. Из органических веществ поверхностно-инактивными относительно воды являются лишь ионизирующиеся вещества, у которых неполярная часть молекулы отсутствует или очень мала. К таким веществам относятся, например, муравьиная и аминоуксусная кислоты. 23 .Классификация дисперсных систем По кинетическим свойствам дисперсной фазы дисперсные системы можно разделить на два класса: · Свободнодисперсные системы, у которых дисперсная фаза подвижна; · Связнодисперсные системы, дисперсионная среда которых твердая, а частицы их дисперсной фазы связаны между собой и не могут свободно перемещаться. В свою очередь эти системы классифицируются по степени дисперсности. Системы с одинаковыми по размерам частицами дисперсной фазы называются монодисперсными, а с неодинаковыми по размеру частицами — полидисперсными. Как правило, окружающие нас реальные системы полидисперсны. По размерам частиц свободнодисперсные системы подразделяют на:
Ультрамикрогетерогенные системы также называют коллоидными или золями. В зависимости от природы дисперсионной среды, золи подразделяют на твёрдые золи, аэрозоли (золи с газообразной дисперсионной средой) и лиозоли (золи с жидкой дисперсионной средой). К микрогетерогенным системам относят суспензии, эмульсии, пены и порошки. Наиболее распространёнными грубодисперсными системами являются системы «твёрдое — газ», например, песок. 24. Хроматография. Виды хроматографии. Хроматогра́фия — динамический сорбционный метод разделения и анализа смесей веществ, а также изучения физико-химических свойств веществ. Основан на распределении веществ между двумя фазами — неподвижной (твердая фаза или жидкость, связанная на инертном носителе) и подвижной. Название метода связано с первыми экспериментами по хроматографии, в ходе которых разработчик метода Михаил Цвет разделял ярко окрашенные растительные пигменты. В зависимости от агрегатного состояния подвижной фазы различают газовую, флюидную и жидкостную хроматографию. В качестве неподвижной фазы используют твердые тела и жидкости. В соответствии с агрегатным состоянием подвижной и неподвижной фаз различают следующие виды хроматографии: 1) газо-твердофазную хроматографию, или газоадсорбционную хроматографию; 2) газо-жидкостную хроматографию (газо-жидко-твердофазную); 3) жидко-твердофазную хроматографию; 4) жидко-жидкофазную хроматографию; 5) флюидно-твердофазную хроматографию; 6) флюидно-жидко-твердофазную хроматографию. По механизму разделения в-в различают адсорбционную, распределительную, ионообменную, эксклюзионную, аффинную (биоспецифическую), осадочную хроматографию. На практике часто реализуется одновременно неск. механизмов разделения. По геометрии сорбционного слоя неподвижной фазы различают колоночную и плоскослойную хроматографию. К плоскослойной относятся тонкослойная хроматография и бумажная хроматография. В колоночной хроматографии обычно выделяют капиллярную хроматографию, в к-рой сорбент расположен на внутр. стенках колонки, а центр, часть колонки остается незаполненной сорбентом, т.е. открытой для потока элюента (хроматография на открытых капиллярных колонках). 25.) Методы получения коллоидных растворов Дисперсионные методы основаны на раздроблении твердых тел до частиц коллоидного размера и образовании таким образом коллоидных растворов. Процесс диспергирования осуществляется различными методами: механическим размалыванием вещества в т.н. коллоидных мельницах, электродуговым распылением металлов, дроблением вещества при помощи ультразвука. Методы конденсации Вещество, находящееся в молекулярно-дисперсном состоянии, можно перевести в коллоидное состояние при замене одного растворителя другим – т.н. методом замены растворителя. В качестве примера можно привести получение золя канифоли, которая не растворяется в воде, но хорошо растворима в этаноле. При постепенном добавлении спиртового раствора канифоли к воде происходит резкое понижение растворимости канифоли, в результате чего образуется коллоидный раствор канифоли в воде. Аналогичным образом может быть получен гидрозоль серы. Коллоидные растворы можно получать также и методом химической конденсации, основанном на проведении химических реакций, сопровождающихся образованием нерастворимых или малорастворимых веществ. Для этой цели используются различные типы реакций – разложения, гидролиза, окислительно-восстановительные и т.д. Так, красный золь золота получают восстановлением натриевой соли золотой кислоты формальдегидом Золи могут быть получены также в результате реакций ионного обмена, в результате которых выделяется нерастворимая соль, образующая при определенных условиях коллоидный раствор; так получают, например, золь иодида серебра (см. ниже). Процесс гидролиза различных солей может приводить к образованию коллоидных растворов нерастворимых гидроксидов или кислот; так получают, например, золь гидроксида железа(III), имеющий следующее строение. 26. Очистка коллоидных систем Наиболее распространенными методами очистки коллоидных систем являются диализ, электродиализ и ультрафильтрация, основанные на свойстве некоторых материалов – т.н. полупроницаемых мембран (коллодия, пергамента, целлофана и т.п.) – пропускать ионы и молекулы небольших размеров и задерживать коллоидные частицы. Все полупроницаемые мембраны представляют собой пористые тела, и непроницаемость их для коллоидных частиц обусловлена тем, что коэффициент диффузии для коллоидных частиц значительно (на несколько порядков) меньше, чем для ионов и молекул, имеющих намного меньшие массу и размеры. Прибор для очистки золей методом диализа называется диализатором; простейший диализатор представляет собой сосуд, нижнее отверстие которого затянуто полупроницаемой мембраной (рис. 4.17). Золь наливают в сосуд и помещают последний в ёмкость с дистиллированной водой (обычно проточной); ионы и молекулы примесей диффундируют через мембрану в растворитель.Диализ является очень медленным процессом; для более быстрой и полной очистки золей применяют электродиализ. Электродиализатор состоит из трех частей; в среднюю часть, отделенную от двух других полупроницаемыми мембранами, за которыми помещены электроды, наливается золь (рис. 4.18). При подключении к электродам разности потенциалов катионы содержащихся в золе электролитов диффундируют через мембрану к катоду, анионы – к аноду. Преимущество электродиализа заключается в возможности удаления даже следов электролитов (необходимо помнить, что степень очистки ограничивается устойчивостью коллоидных частиц; удаление из золя ионов-стабилизаторов приведет к коагуляции). Еще одним методом очистки золей является ультрафильтрация – отделение дисперсной фазы от дисперсионной среды путем фильтрования под давлением через полупроницаемые мембраны. При ультрафильтрации коллоидные частицы остаются на фильтре (мембране). 27. ДЭС Гельмгольца Двойной электрический слой (межфазный) (ДЭС) — слой ионов, образующийся на поверхности частиц в результате адсорбции ионов из раствора, диссоциации поверхностного соединения или ориентировании полярных молекул на границе фаз. Ионы, непосредственно связанные с поверхностью называются потенциалопределяющими. Заряд этого слоя компенсируется зарядом второго слоя ионов, называемых противоионами. ервая модель ДЭС открыта Гельмгольцем , он представлял ДЭС в виде двух обкладок плоского конденсатора, одна обкладка расположена непосредственно на поверхности электрода, вторая – в электролите. d = диаметру молекул Н2О. Так как все заряды сконцентрированы в двух плоскостях, то изменение потенциала по мере удаления от поверхности электрода Е 0 будет описываться прямой линией. Еа – величина электродного удаления от поверхности электрода потенциала. Используя теорию конденсатора, Гельмгольц рассчитал величину заряда ДЭС и величину дифференциальной емкости ДЭС. q – величина заряда = (D /4π 2)Е 0, С – дифференциальная емкость ДЭС = D /4π 2, D – диэлектрическая проницаемость раствора, d – расстояние между обкладками конденсатора. 28.ДЭС Гуи Двойной электрический слой имеет диффузионное (размытое) строение и все противоионы находятся в его диффузи-онной части (рис.11.6). Такое строение определяется соотношением сил электростатического притяжения ионов, за- висящего от электрического потенциала, и тепловым движ
|
||||||||||||
|
Последнее изменение этой страницы: 2016-08-16; просмотров: 910; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 52.15.233.83 (0.015 с.) |

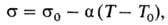

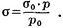

 Изотерма мономолекулярной адсорбции
Изотерма мономолекулярной адсорбции



