
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Внутрішня енергія і перший закон термодинаміки.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Хімічна термодинаміка Залежно від поставлених завдань розрізняють термодинаміку загальну, технічну і хімічну. Хімічна термодинаміка вивчає хімічні і фізичні процеси на основі енергетичних явищ, що супроводжують ці процеси. Предметом термодинаміки є вивчення законів взаємних перетворень різних видів енергії, пов’язаних з переходами енергії між тілами у формі теплоти та виконаної роботи. Сукупність всіх видів енергії розглядається як єдина внутрішня енергія системи Термодинаміка розглядає лише тіла макроскопічних розмірів (мінімальний розмір визначається статистичною термодинамікою і в деяких випадках це близько 1 мкм). В термодинаміці об’єктом дослідження є тіло або група тіл, уявно або фізично виділених з матеріального світу в термодинамічну систему. Система, яка не може обмінюватися із зовнішнім середовищем речовиною і енергією у вигляді теплоти або роботи, називається ізольованою. Термодинамічними параметрами є температура, тиск, маса, густина і хімічний склад фаз, що входять в систему та деякі інші властивості. Зміна будь якого термодинамічного параметра викликає зміну термодинамічного стану системи. Циклічними процесами, або циклами, називають такі, під час яких система змінювала свої властивості, але знову повернулась до свого початкового стану. В результаті термодинамічних процесів здійснюється передача (перерозподіл) теплоти і виконується робота. механічна робота виконується лише тоді, коли під дією сили здійснюється переміщення. Елементарна робота
Робота вимірюється у джоулях, ергах, електрон-вольтах.
Внутрішня енергія і перший закон термодинаміки. Нехай в термодинамічній системі здійснюється передача елементарної кількості тепла
Диференціал внутрішньої енергії дорівнює різниці переданої елементарної теплоти і виконаної елементарної роботи. Це перший закон термодинаміки, записаний в диференціальній формі. Якщо термодинамічна система здійснює перехід із стану (1) до стану (2), то можна записати інтеграл:
Введемо позначення:
отже,
Зміна внутрішньої енергії термодинамічної системи при її переході від одного стану до іншого дорівнює різниці переданої теплоти і виконаної роботи. Це інтегральна форма запису першого закону термодинаміки. Якщо процес циклічний, то Не можливо шляхом повторення циклічних процесів накопичувати енергію в системі. В таких процесах Запишемо ще одне формулювання першого закону термодинаміки: Енергія не створюється і не зникає, лише перетворюється з одного виду в інший і переходить від одного тіла до іншого в еквівалентних кількостях.
Теплоємність Середню питому (с) або мольну теплоємність (С) можна визначити експериментально як відношення кількості теплоти
Щоб знайти істинні значення теплоємностей, необхідною умовою є
При низьких температурах (нижче 15К) теплоємність можна пояснити лише з позицій квантової теорії. У спрощеній формі ця теорія дає такий вираз для низькотемпературної теплоємності:
ЦИКЛ КАРНО В теплових машинах деяка кількість речовини, що називається робочим тілом, здійснює циклічну послідовність процесів і перетворює теплоту в роботу, періодично повертаючись до початкового стану. Цикл Карно – оборотний цикл, який складається з чотирьох процесів: двох ізотермічних і двох адіабатних. Робочим тілом є ідеальний газ. Можна показати, що коефіцієнт корисної дії теплової машини можна виразити через температури нагрівника
З іншого боку, к.к.д. можна виразити через відібрану від нагрівника теплоту
Другий закон термодинаміки Перший закон термодинаміки стверджує, що при перетворенні однієї форми енергії в іншу повна енергія зберігається, але не вказує ніяких інших обмежень відносно процесів перетворень. Другий закон термодинаміки дає можливість розрахувати, яка ж частина теплоти може бути перетворена в роботу при циклічному процесі, та вказати, чи є даний процес самочинним чи ні. Самочинними (або позитивними) називають такі процеси, які протікають самі по собі, без зовнішнього впливу в напрямку досягнення термодинамічною системою рівноваги. Якщо процеси здійснюються під дією зовнішнього впливу в напрямку віддалення системи від стану рівноваги, то їх називають не самочинними, або негативними. В ізольованій системі виключаються всілякі зовнішні впливи, тому в ній можуть протікати лише самочинні процеси. Передбачати напрямок процесу дає можливість другий закон термодинаміки: Єдиним результатом будь-якої сукупності процесів не може бути перехід теплоти від менш нагрітого тіла до більш нагрітого (постулат Клаузіуса). Процеси теплопровідності є незворотними. Єдиним результатом будь-якої сукупності процесів не може бути перетворення теплоти в роботу, тобто не можна створити вічний двигун другого роду (постулат Томсона). Перший закон термодинаміки заперечує можливість створення машини, яка творила б енергію з нічого. Другий закон термодинаміки заперечує можливість створення такої машини, яка змогла б перетворювати теплоту навколишнього середовища в роботу лише за рахунок охолодження навколишнього середовища. Ентропія Відомо, що для оборотного циклу Карно ККД може бути записаний через взяту у нагрівника теплоту Q 1 та прийняту холодильником теплоту Q 2, або через їх температури, відповідно T 1 і T 2.
Прирівняємо праві частини цих виразів:
Відношення
Обчислення ентропії Для обчислення ентропії ідеального газу застосуємо перший закон термодинаміки в диференціальній формі: Розділивши на
Інтегруючи вираз, знаходимо зміну ентропії в термодинамічному процесі:
Підставивши межі інтегрування можна записати:
Якщо Очевидно, що для n молів відповідні зміни ентропії будуть в n разів більшими. 1. Мольна ентропія речовини змінюється за рахунок зміни температури. При збільшенні температури (при нагріванні) ентропія зростає і навпаки.
2. Ентропія зростає при зростанні об`єму газу. 3. Ріст ентропії характеризує зменшення порядку в термодинамічній системі. При збільшенні температури посилюється тепловий рух, а при збільшенні об`єму зменшується ймовірність того, що в заданому елементарному об`ємові Δnвдасться знайти молекулу. Сказане яскраво демонструється зміною ентропії при фазових переходах першого роду (випаровування і плавлення). Ці процеси є ізотермічними (Т = const). Зміна ентропії ізотермічного процесу буде:
Ентропія суміші газів Якщо сполучити два резервуари з різними газами, то гази почнуть дифундувати з одного об’єму до іншого навіть тоді, коли тиск і температура в обох резервуарах будуть однаковими. Якщо гази ідеальні, то компоненти системи (гази) вестимуть себе незалежно один від іншого. При ізотермічно – ізобарному процесі зміна ентропії дорівнює сумі таких змін для кожного газу при його розширенні до об`єму v, тобто, ентропія є величиною екстенсивною:
де
З одержаного рівняння видно, що зміна ентропії при змішуванні завжди позитивна Наприклад, змішується два молі азоту і один водню при однакових для обох газів початкових умовах. Запишемо:
Постулат Планка. Абсолютні значення ентропії Ентропія індивідуальної кристалічної речовини при абсолютному нулю дорівнює нулю: Цей постулат справедливий лише для ідеальних кристалів, тобто, таких, у яких немає ніяких дефектів. Якщо у кристалі присутні дефекти, то вони будуть збільшувати його ентропію, адже дефекти – це будь які порушення порядку. При температурі T для ідеального кристалу можна обчислити абсолютне значення ентропії:
Слід нагадати, що
Постулат Планка використовується для обчислення абсолютних значень ентропій хімічних сполук. Це важливо при розрахунку хімічних рівноваг. Рівняння для обчислення абсолютної ентропії газу при деякій температурі
Хімічний потенціал До цього часу ми розглядали закриті системи, тобто такі, які не можуть обмінюватися із зовнішнім середовищем речовиною, але обмінюється енергією. Тепер розглянемо відкриту систему, в якій маси різних компонентів
Знайдемо повний диференціал внутрішньої енергії для відкритої термодинамічної системи:
Розглянемо перший закон термодинаміки для закритої системи, яка не обмінюється речовиною з навколишнім середовищем:
де
або, враховуючи, що для такої системи U = U(S,v), знайдемо:
Порівнюючи два вирази, одержимо:
Коефіцієнт при
тут
Хімічний потенціал є інтенсивною величиною, яка характеризує дану фазу подібно до тиску та температури. Наприклад, різниця хімічних потенціалів у двох фазах визначає напрям, в якому буде відбуватися самочинна дифузія речовини аналогічно тому, як різниця температур визначає напрям потоку тепла. Задача Обчисліть для вказаної хімічної реакції зміни ентальпії, ентропії та зміну енергії Гіббса. Якою буде реакція - екзотермічною, чи ендотермічною? Чи буде реакція протікати самочинно при температурі 570С? Поясніть одержані результати. Приклад розв’язування: MgCO3(тв) ®MgO(тв) +CO2 DH0MgCO3 = - 1113 кДж/моль; DS0MgCO3 = 66 Дж/K моль DH0MgO = 601,8 кДж/моль; DS0MgO= 27 Дж/K моль DH0CO2 = - 393,5 кДж/моль; DS0CO2 = 214 Дж/K моль Знаходимо зміну ентальпії реакції: DH0 = [1×(-602)+1(-394)]-[1(-1113)]= +117 кДж/Kмоль Знаходимо зміну ентропії: DS0 = 1×27 +1×214-1×66= 175 Дж/K моль = 0,175 кДж/K моль Зміну енергії Гіббса при температурі T знаходимо за формулою: DG=DH0-TDS0 Варіанти завдання
Хімічна термодинаміка Залежно від поставлених завдань розрізняють термодинаміку загальну, технічну і хімічну. Хімічна термодинаміка вивчає хімічні і фізичні процеси на основі енергетичних явищ, що супроводжують ці процеси. Предметом термодинаміки є вивчення законів взаємних перетворень різних видів енергії, пов’язаних з переходами енергії між тілами у формі теплоти та виконаної роботи. Сукупність всіх видів енергії розглядається як єдина внутрішня енергія системи Термодинаміка розглядає лише тіла макроскопічних розмірів (мінімальний розмір визначається статистичною термодинамікою і в деяких випадках це близько 1 мкм). В термодинаміці об’єктом дослідження є тіло або група тіл, уявно або фізично виділених з матеріального світу в термодинамічну систему. Система, яка не може обмінюватися із зовнішнім середовищем речовиною і енергією у вигляді теплоти або роботи, називається ізольованою. Термодинамічними параметрами є температура, тиск, маса, густина і хімічний склад фаз, що входять в систему та деякі інші властивості. Зміна будь якого термодинамічного параметра викликає зміну термодинамічного стану системи. Циклічними процесами, або циклами, називають такі, під час яких система змінювала свої властивості, але знову повернулась до свого початкового стану. В результаті термодинамічних процесів здійснюється передача (перерозподіл) теплоти і виконується робота. механічна робота виконується лише тоді, коли під дією сили здійснюється переміщення. Елементарна робота
Робота вимірюється у джоулях, ергах, електрон-вольтах.
Внутрішня енергія і перший закон термодинаміки. Нехай в термодинамічній системі здійснюється передача елементарної кількості тепла
Диференціал внутрішньої енергії дорівнює різниці переданої елементарної теплоти і виконаної елементарної роботи. Це перший закон термодинаміки, записаний в диференціальній формі. Якщо термодинамічна система здійснює перехід із стану (1) до стану (2), то можна записати інтеграл:
Введемо позначення:
отже,
Зміна внутрішньої енергії термодинамічної системи при її переході від одного стану до іншого дорівнює різниці переданої теплоти і виконаної роботи. Це інтегральна форма запису першого закону термодинаміки. Якщо процес циклічний, то Не можливо шляхом повторення циклічних процесів накопичувати енергію в системі. В таких процесах Запишемо ще одне формулювання першого закону термодинаміки: Енергія не створюється і не зникає, лише перетворюється з одного виду в інший і переходить від одного тіла до іншого в еквівалентних кількостях.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-08-12; просмотров: 467; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 52.14.9.138 (0.013 с.) |

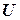 . Сюди входять: механічна, що складається з кінетичної і потенціальної енергій тіла, кінетична енергія теплового руху атомів і молекул, з яких тіло складається, енергія міжатомних і міжмолекулярних зв’язків, утворених валентними електронами, енергія електростатичної і магнітної взаємодії, ядерна енергія та інші види енергії.
. Сюди входять: механічна, що складається з кінетичної і потенціальної енергій тіла, кінетична енергія теплового руху атомів і молекул, з яких тіло складається, енергія міжатомних і міжмолекулярних зв’язків, утворених валентними електронами, енергія електростатичної і магнітної взаємодії, ядерна енергія та інші види енергії. дорівнює добутку модуля вектора сили
дорівнює добутку модуля вектора сили  на модуль елементарного переміщення
на модуль елементарного переміщення 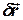 і на косинус кута між ними, тобто, скалярному добутку цих векторів:
і на косинус кута між ними, тобто, скалярному добутку цих векторів: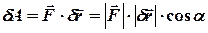
 ;
; 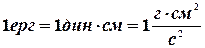 ;
;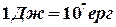 ;
;  .
.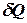 і виконується елементарна робота
і виконується елементарна робота 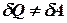 . Позначимо різницю цих величин через диференціал деякої функції
. Позначимо різницю цих величин через диференціал деякої функції 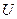 , яку назвемо внутрішньою енергією системи:
, яку назвемо внутрішньою енергією системи: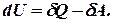

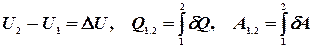 ,
,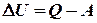 .
.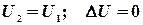 , тобто внутрішня енергія системи не зміниться при завершенні циклу. Можна так сформулювати перший закон термодинаміки:
, тобто внутрішня енергія системи не зміниться при завершенні циклу. Можна так сформулювати перший закон термодинаміки: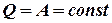 , тобто, не можна побудувати вічний двигун 1-го роду, який виконував би роботу без затрати еквівалентної кількості якогось виду енергії.
, тобто, не можна побудувати вічний двигун 1-го роду, який виконував би роботу без затрати еквівалентної кількості якогось виду енергії.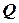 , що поглинається при нагріванні відповідно 1кілограму або 1 моля речовини на
, що поглинається при нагріванні відповідно 1кілограму або 1 моля речовини на 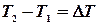 градусів при заданих умовах. Розрізняють теплоємність при сталому тиску
градусів при заданих умовах. Розрізняють теплоємність при сталому тиску 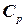 або сталому об’ємі
або сталому об’ємі  . Середня теплоємність
. Середня теплоємність  в температурному інтервалі
в температурному інтервалі 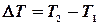 визначається відношенням переданого тепла
визначається відношенням переданого тепла  :
: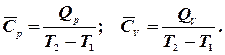
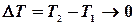 , тобто,
, тобто, 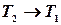 :
: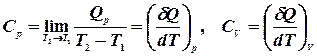 .
.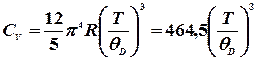 (формула Дебая)
(формула Дебая) – температура Дебая. Вона знаходиться емпірично для кожної речовини і дається в довідниках.
– температура Дебая. Вона знаходиться емпірично для кожної речовини і дається в довідниках. і холодильника
і холодильника  . Чим більша різниця температур, тим вищий к.к.д.
. Чим більша різниця температур, тим вищий к.к.д. .
.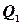 і теплоту, прийняту холодильником
і теплоту, прийняту холодильником  : чим більша різниця цих теплот, тим вищий к.к.д..
: чим більша різниця цих теплот, тим вищий к.к.д..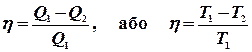

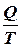 називають приведеною теплотою. Різниця приведених теплот нагрівника і холодильника дорівнює нулю. Це справедливо і для нескінченно малого оборотного циклу Карно:
називають приведеною теплотою. Різниця приведених теплот нагрівника і холодильника дорівнює нулю. Це справедливо і для нескінченно малого оборотного циклу Карно: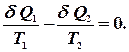

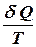 називається елементарною приведеною теплотою для нескінченно малого циклу. Вона дорівнює повному диференціалу від ентропії (від грецького troph - перетворення).
називається елементарною приведеною теплотою для нескінченно малого циклу. Вона дорівнює повному диференціалу від ентропії (від грецького troph - перетворення).
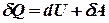 , або
, або 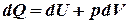 . Введемо заміни:
. Введемо заміни: 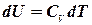 ;
; 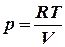 ;
; 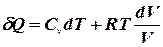 .
.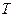 одержимо диференціал ентропії:
одержимо диференціал ентропії:

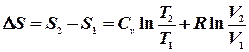
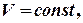 то
то 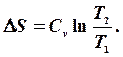 Якщо
Якщо  то
то 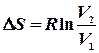 .
.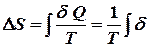
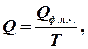
 - це мольна теплота (ентальпія) фазового переходу першого роду (прихована теплота плавлення або випаровування), якщо система приймає тепло, то ентропія зростає. Отже, при плавленні збільшується безпорядок в системі. Зникає далекий порядок, залишається лише ближній, у рідині утворюються мікропустоти (до 3% від її об`єму). Зростає тепловий рух. Те ж саме відбувається і при випаровуванні. Порядок зменшується. Зникає ближній порядок, атоми і молекули переходять у газову фазу, де ймовірність їх знайти в заданому елементарному об’ємі зменшується при збільшенні об`єму. Отже, ентропія – це міра безпорядку.
- це мольна теплота (ентальпія) фазового переходу першого роду (прихована теплота плавлення або випаровування), якщо система приймає тепло, то ентропія зростає. Отже, при плавленні збільшується безпорядок в системі. Зникає далекий порядок, залишається лише ближній, у рідині утворюються мікропустоти (до 3% від її об`єму). Зростає тепловий рух. Те ж саме відбувається і при випаровуванні. Порядок зменшується. Зникає ближній порядок, атоми і молекули переходять у газову фазу, де ймовірність їх знайти в заданому елементарному об’ємі зменшується при збільшенні об`єму. Отже, ентропія – це міра безпорядку.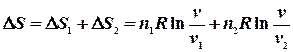 ,
, кількості молів кожного газу при температурі
кількості молів кожного газу при температурі 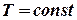 і спільному тиску
і спільному тиску 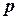 . Кожен газ змінює свій об`єм від початкових об’ємів
. Кожен газ змінює свій об`єм від початкових об’ємів 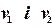 до об`єму суміші
до об`єму суміші  .
.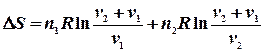 .
.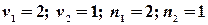


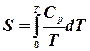 .
.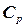 змінюється пропорційно T 3
змінюється пропорційно T 3  , отже,
, отже, 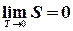 . В принципі абсолютний нуль досягти неможливо. Залишаються нульові коливання.
. В принципі абсолютний нуль досягти неможливо. Залишаються нульові коливання. має вид:
має вид:
 або відповідна кількість їх молів
або відповідна кількість їх молів  можуть довільно змінюватися. Це означає, що внутрішня енергія системи при
можуть довільно змінюватися. Це означає, що внутрішня енергія системи при 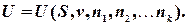
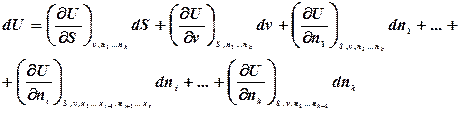
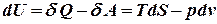

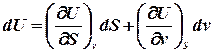
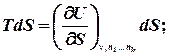
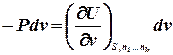
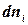 називають хімічним потенціалом.
називають хімічним потенціалом.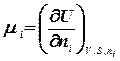
 означає всі речовини, крім і – тої. Приріст будь-якої термодинамічної функції при зміні маси даної речовини за умови незмінності всіх інших параметрів системи, називається хімічним потенціалом.
означає всі речовини, крім і – тої. Приріст будь-якої термодинамічної функції при зміні маси даної речовини за умови незмінності всіх інших параметрів системи, називається хімічним потенціалом.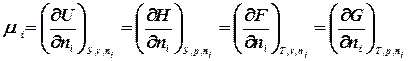
 O2(г) = CO2(г) + 2H2O(р)
5. C2H4(г) +3O2(г) = 2CO2(г) + 2H2O(г)
6. MgO(к) + CO2(г) = MgCO3(к)
7. FeO(к) + CO(г) = Fe(г) + CO2(г)
8. C2H6(г) +
O2(г) = CO2(г) + 2H2O(р)
5. C2H4(г) +3O2(г) = 2CO2(г) + 2H2O(г)
6. MgO(к) + CO2(г) = MgCO3(к)
7. FeO(к) + CO(г) = Fe(г) + CO2(г)
8. C2H6(г) +  O2(г) =2CO2(г) +3H2O(г)
9. C6H6(р) +
O2(г) =2CO2(г) +3H2O(г)
9. C6H6(р) + 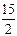 O2 (г) =6CO2(г) +3H2O(р)
10. 2H2S(г) +3O2(г) = 2H2O(р) +2SO2(г)
11. 2CH3OH(г) +3O2(г) =4H2O(г) +2CO2(г)
12. C2H2(г) +
O2 (г) =6CO2(г) +3H2O(р)
10. 2H2S(г) +3O2(г) = 2H2O(р) +2SO2(г)
11. 2CH3OH(г) +3O2(г) =4H2O(г) +2CO2(г)
12. C2H2(г) + 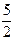 O2(г) = 2CO2(г) +H2O(р)
O2(г) = 2CO2(г) +H2O(р)
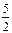 O2(г) = 2CO2(г) + H2O(p)
26. H2(г) + CO2(г) = CO(г) + H2O(р)
27. 2NO(г) + O2(г) = 2NO2(г)
28. NH3(г) + HCl(г) = NH4Cl(к)
O2(г) = 2CO2(г) + H2O(p)
26. H2(г) + CO2(г) = CO(г) + H2O(р)
27. 2NO(г) + O2(г) = 2NO2(г)
28. NH3(г) + HCl(г) = NH4Cl(к)
 ,
кДж/моль
,
кДж/моль



