
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Хімічний потенціал ідеального газуСодержание книги Поиск на нашем сайте
Для одного моля ідеального газу можна записати:
Якщо Нехай відбувається нескінченно мала зміна кількості молів ідеального газу
Це означає, що хімічний потенціал дорівнює термодинамічному потенціалу одного моля газу. Отже,:
Застосувавши рівняння Клапейрона – Менделєєва, запишемо:
Розділивши змінні після інтегрування одержимо:
тут Якщо
Фізичні і хімічні процеси, які супроводжуються виділенням тепла в навколишнє середовище, називають екзотермічними. Процеси, які ідуть з поглинанням тепла є ендотермічними. Більшість хімічних реакцій, зокрема тих, які протікають у живих організмах здійснюються при атмосферному тискові, який можна вважати сталим. Наприклад, згорання спирту є процесом екзотермічним. якщо згорання відбувається у організмі людини, то процес ітиме при температурі приблизно 37оС. Така реакція є каталітичною і каталізатором служать ферменти у організмі людини. Для того, щоб запалити спирт (запустити екзотермічну реакцію горіння без каталізатора) необхідно його спочатку нагріти. далі вона буде підтримуватися за рахунок теплоти, що виділятиметься при горінні: реагенти продукти реакції С2Н5ОН+3О2 = 2СО2 + 3Н2О Щоб обчислити кількість теплоти, яка виділяється в процесі горіння, потрібно знати теплоти утворення кожної сполуки у цій реакції. Теплотою утворення (ентальпією) даної сполуки називають тепловий ефект реакції утворення 1 моль сполуки із простих речовин, взятих у їх стійкому стані при тиску 1 атм. (1,013×105 Па) і температурі 25 0С (278 К). (стандартні умови). DН0А – стандартна ентальпія утворення речовини. Ці дані даються у спеціальних довідкових таблицях. Знак “ – “ означає, що реакція утворення екзотермічна, “ + “ – ендотермічна. Знак “‑” означає, що екзотермічні процеси ведуть до зменшення внутрішньої енергії термодинамічної системи. хімічну реакцію можна записати в загальному вигляді: аА + bВ= сС + dD, де А, В – речовини, що реагують, тобто, реагенти, С, D – речовини, які утворилися в процесі реакції, тобто, продукти, а, b, с, d ‑ стехіометричні коефіцієнти. Теплоту реакції (тепловий ефект) обчислюють за формулою: DH0 =(c×DHС0 +d×DHD0) – (a×DHA0+ b×DHB0). Ця формула означає, що тепловий ефект хімічної реакції (DH0) дорівнює алгебраїчній сумі помножених на відповідні стехіометричні коефіцієнти теплот утворення продуктів мінус алгебраїчну суму помножених на стехіометричні коефіцієнти теплот утворення реагентів. Фізичні процеси, які протікають самі по собі без зовнішнього впливу і відбуваються у напрямку досягнення термодинамічною системою рівноваги, називають самочинними. Наприклад, якщо з’єднати два балони, в одному з яких є ідеальний газ, а інший порожній, і відкритий кран, то газ із першого балона заповнить другий і в обох балонах встановиться однаковий тиск. Цей процес ітиме завжди лише в одному напрямку. Самостійно повернутися назад газ уже ніколи не зможе. Ймовірність самочинного звільнення газом одного із балонів дорівнює нулю. Такий процес може бути здійсненим лише під зовнішнім впливом, наприклад з використанням насоса, тобто, не самочинно. Самочинними можуть бути як екзотермічні процеси, так і ендотермічні. Наприклад, плавлення льоду. У ізольованих системах можуть протікати лише самочинні процеси. Передбачити напрямок самочинного процесу можна спостерігаючи за зміною ступеню невпорядкованості системи, або оцінюючи його математично. Тенденцію до зміни впорядкованості системи характеризує величина, яка називається ентропією. Ентропія зростає із збільшенням невпорядкованості. Це нагрівання, випаровування, плавлення, розширення газу, руйнування хімічних зв’язків, змішування і багато іншого. Такі процеси як конденсація, кристалізація, полімеризація, зміцнення зв’язків, розділення речовин чи частинок, стиснення та інше супроводжуються зменшенням ентропії. ентропія є функцією стану термодинамічної системи. Вона однозначно характеризує початковий і кінцевий стани системи і не залежать від шляху (способу), яким система змінює свій стан. Значення абсолютної ентропії утворення при стандартних умовах для різних речовин (DS0А) приводиться у довідниках. Зміна ентропії DS0 у хімічній реакції визначається різницею між сумами ентропій всіх продуктів і сумами ентропій всіх реагентів з урахуванням відповідних стехіометричних коефіцієнтів: DS0=(сSC0+dSD0)-(aSA0+bSB0) Для того, щоб можна було передбачити напрямок хімічної реакції вводиться ще одна функція стану системи – вільна енергія, або інакше, вільна енергія Гіббса G. Вона пов’язана із ентропією та ентальпією виразом: G=H-TS. Зміну вільної енергії при сталих тиску і температурі знаходять так: DG=DH0-TDS0 Ця формула є наближеною. В ній не враховується залежність D H0 і D S0 від температури. Якщо D G0< 0, то реакція може протікати самочинно. Якщо D G0 > 0,то така реакція самочинно не відбувається. Для того, щоб вона пішла в прямому напрямку, над системою потрібно виконати роботу зовнішніх сил. Обчислюють D G0 за формулою: D G=(с D Gс0+ d D GД0)- (а D GА0+в D GВ0) Дані про стандартні вільні енергії утворення беруть із довідників. Задача Обчисліть для вказаної хімічної реакції зміни ентальпії, ентропії та зміну енергії Гіббса. Якою буде реакція - екзотермічною, чи ендотермічною? Чи буде реакція протікати самочинно при температурі 570С? Поясніть одержані результати. Приклад розв’язування: MgCO3(тв) ®MgO(тв) +CO2 DH0MgCO3 = - 1113 кДж/моль; DS0MgCO3 = 66 Дж/K моль DH0MgO = 601,8 кДж/моль; DS0MgO= 27 Дж/K моль DH0CO2 = - 393,5 кДж/моль; DS0CO2 = 214 Дж/K моль Знаходимо зміну ентальпії реакції: DH0 = [1×(-602)+1(-394)]-[1(-1113)]= +117 кДж/Kмоль Знаходимо зміну ентропії: DS0 = 1×27 +1×214-1×66= 175 Дж/K моль = 0,175 кДж/K моль Зміну енергії Гіббса при температурі T знаходимо за формулою: DG=DH0-TDS0 Варіанти завдання
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-08-12; просмотров: 337; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.118.126.69 (0.007 с.) |

 .
.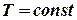 , то
, то  . Тоді
. Тоді  .
. , що супроводжується відповідною зміною термодинамічного потенціалу
, що супроводжується відповідною зміною термодинамічного потенціалу  . Запишемо хімічний потенціал газу:
. Запишемо хімічний потенціал газу:




 - хімічні потенціали чистого газу при температурі
- хімічні потенціали чистого газу при температурі  та тисках
та тисках  .
. , то маємо:
, то маємо:  .
.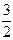 O2(г) = CO2(г) + 2H2O(р)
5. C2H4(г) +3O2(г) = 2CO2(г) + 2H2O(г)
6. MgO(к) + CO2(г) = MgCO3(к)
7. FeO(к) + CO(г) = Fe(г) + CO2(г)
8. C2H6(г) +
O2(г) = CO2(г) + 2H2O(р)
5. C2H4(г) +3O2(г) = 2CO2(г) + 2H2O(г)
6. MgO(к) + CO2(г) = MgCO3(к)
7. FeO(к) + CO(г) = Fe(г) + CO2(г)
8. C2H6(г) +  O2(г) =2CO2(г) +3H2O(г)
9. C6H6(р) +
O2(г) =2CO2(г) +3H2O(г)
9. C6H6(р) + 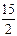 O2 (г) =6CO2(г) +3H2O(р)
10. 2H2S(г) +3O2(г) = 2H2O(р) +2SO2(г)
11. 2CH3OH(г) +3O2(г) =4H2O(г) +2CO2(г)
12. C2H2(г) +
O2 (г) =6CO2(г) +3H2O(р)
10. 2H2S(г) +3O2(г) = 2H2O(р) +2SO2(г)
11. 2CH3OH(г) +3O2(г) =4H2O(г) +2CO2(г)
12. C2H2(г) + 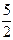 O2(г) = 2CO2(г) +H2O(р)
O2(г) = 2CO2(г) +H2O(р)
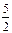 O2(г) = 2CO2(г) + H2O(p)
26. H2(г) + CO2(г) = CO(г) + H2O(р)
27. 2NO(г) + O2(г) = 2NO2(г)
28. NH3(г) + HCl(г) = NH4Cl(к)
O2(г) = 2CO2(г) + H2O(p)
26. H2(г) + CO2(г) = CO(г) + H2O(р)
27. 2NO(г) + O2(г) = 2NO2(г)
28. NH3(г) + HCl(г) = NH4Cl(к)
 ,
кДж/моль
,
кДж/моль



