
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Активность и коэффициент активности компонента металлического раствора и их расчет.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Под активностью компонента в растворе понимают отношение парциального давления пара компонента над раствором к давлению пара этого же вещества, находящегося в стандартном состоянии
Коэффициент активности количественно характеризует отличие реального раствора от идеального при определенной концентрации. Для описания отклонений реальных растворов от закона Генри служит коэффициент активности
- При положительных отклонениях от закона Генри
- концентрация i-го компонента металлического расплава, % масс. 21. Кинетика и ее задачи. Кинетическое уравнение. Константа скорости и ее зависимость от температуры (уравнение Аррениуса), порядок реакции, энергия активации и их определение. Химическая кинетика – наука, изучающая количественные закономерности химических процессов, протекающих во времени Основной закон формальной кинетики: скорость реакции в прямом направлении пропорциональна концентрациям реагирующих веществ Задачи: -нахождение математического описания зависимости скорости от параметра (Т,С).Найти кинетическое уравнение. -установление механизма процесса и нахождение кинетических констант Уравнения, выражающие связь между скоростью реакции и концентрациями,
К-константа скорости. (коэффициент пропорциональности в кинетическом уравнении, связывающем скорость реакции с концентрациями реагирующих веществ и их стехиометрическими коэффициентами) Порядок реакции (n) – сумма показателей, с которыми концентрации входят в кинетическое уравнение. Нулевой порядок. (Скорость реакции постоянна и не зависит от времени).
Второй порядокскорость пропорциональна концентрации во второй степени
Е – энергия активации процесса (кажущаяся), представляет собой разность
между средней энергией реагирующих частиц и средней энергией всех частиц, участвующих в соударениях. Гетерогенные процессы. Диффузионная и кинетическая области реагирования. Лимитирующая стадия. Реакции, в которых реагирующие вещества находятся в разных фазах, называются гетерогенными Гетерогенные процессы, связанные с переносом реагентов из объема фаз к поверхности, где происходит химическая реакция, и отводом от нее продуктов реакции, являются многостадийными Перенос вещества называется массопереносом. Различают внешнюю и внутреннюю массопередачу. Скорость многостадийного процесса определяется скоростью самой медленной стадии, которая называется лимитирующей. Кинетика реакций, в которых наиболее медленным звеном является перенос вещества (подвод или отвод реагентов), называется диффузионной кинетикой. Процесс идет в диффузионной области(лимитирует диффузия), Процесс идет в кинетической области (лимитирует химическая реакция) В металлургических процессах часто скорость химической реакции высока и не лимитирует скорость процесса. Концентрационный кислородный гальванический элемент с твердым электролитом. Его устройство, принцип работы. Схема измерения ЭДС. Температурные пределы использования кислородных датчиков. Гальванический элемент - устройство, преобразующее химическую энергию в электрическую .
2. Электрод II теряет электроны и становится положительно заряженным, электрод I приобретает электроны и становится отрицательно заряженным.
- равновесное парциальное давление кислорода в электроде сравнения (известно)
- равновесное парциальное давление кислорода в исследуемой фазе
Учет в расчетах электронной проводимости твердых электролитов.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-08-01; просмотров: 683; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.17.156.114 (0.009 с.) |


 Активность имеет тот же физ смысл, что и концентрация, но учитывает взаимодействие частиц в растворе
Активность имеет тот же физ смысл, что и концентрация, но учитывает взаимодействие частиц в растворе



 - -в области идеального разбавленного раствора
- -в области идеального разбавленного раствора - При отрицательных отклонениях
- При отрицательных отклонениях

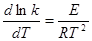 называются кинетическими
называются кинетическими Уравнение Аррениуса:
Уравнение Аррениуса:


 Первый порядок.(Скорость пропорциональна концентрации впервой степени
Первый порядок.(Скорость пропорциональна концентрации впервой степени




 Электродные реакции на границах: 1.
Электродные реакции на границах: 1.
 24. Уравнение Нернста. Его получение и использование в расчетах.
24. Уравнение Нернста. Его получение и использование в расчетах.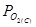

 (нужно определить)
(нужно определить)


