
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Идеальный газ. Уравнение состояния. Закон дальтона. Реальные газы.Содержание книги
Поиск на нашем сайте Идеальный газ. Уравнение состояния. Закон Дальтона. Реальные газы. Модель идеального газа 1.Молекулы (атомы)принимаются за материальные точки с определенной массой.Размеры их ничтожны по сравнению с расстоянием между ними. 2.Молекулы(атомы) находятся в состоянии непрерывного и постоянного движения.Между столкновениями они движутся прямолинейно. Движения равновероятны по всем направлениям. 3.Скорости частиц могут быть любыми. 4.При столкновении молекулы (атомы)ведут себя как упругие шары. Между частицами не действуют силы притяжения или отталкивания
V-молярный объём, R-молярная газовая постоянная.
давлений компонентов. Парциальное давление компонентов в смеси, это давление, которое он оказывает, занимая весь тот объем, что и смесь, при той же температуре. При повышении плотности изменяются свойства газов – они перестают быть идеальными. Простейшим уравнением, которое качественно правильно описывает отличие реального газа от идеального, является уравнение Ван-дер-Ваальса
3. Внутренняя энергия и энтальпия. Первый закон термодинамики. Характеризует общий запас энергии системы, включает все виды движения и взаимодействия частиц, составляющих систему. Так, внутренняя энергия U тела складывается из кинетической энергии движущихся молекул и потенциальной энергии, т.е. энергии взаимного притяжения и отталкивания частиц (молекул). Во внутреннюю энергию также входят: энергия электронов, ядерная энергия и т.д. Внутренняя энергия U системы (тела) должна зависеть от температуры Т (кинетическая энергия молекул) и от объема V, так как потенциальная энергия – энергия взаимного притяжения и отталкивания, зависит от расстояния между молекулами.
Внутренняя энергия не может равняться нулю (нет веществ без движения). Она всегда положительна и тем больше, чем больше движение. 2. Внутренняя энергия изолированной системы всегда остается постоянной величиной, независимо от протекающих в системе процессов. 3. Внутренняя энергия складывается из отдельных видов энергии, которые превращаются друг в друга в строго эквивалентных количествах. 4. Внутренняя энергия является однозначной функцией состояния системы, т.е. каждому состоянию системы соответствует одно значение внутренней энергии. Абсолютное значение внутренней энергии системы определить невозможно, но в термодинамике это и не нужно. Достаточно знать изменение внутренней энергии при переходе системы из одного состояния в другое. Первый закон термодинамики является обобщением закона сохранения и превращения энергии для термодинамической системы. Он формулируется следующим образом: Изменение ΔU внутренней энергии неизолированной термодинамической системы равно разности между количеством теплоты Q, переданной системе, и работой A, совершенной системой над внешними телами.
Рассмотреть превращения при охлаждении и кристаллизации расплава конкретного состава, Применить правило фаз, правило отрезков. Диаграммы состояния двухкомпонентных систем позволяют определять число и вид фаз, находящихся в равновесии при определенных условиях, массовые соотношения между фазами для любой температуры ДИАГРАММА СОСТОЯНИЯ ДЛЯ СИСТЕМ С НЕОГРАНИЧЕННОЙ РАСТВОРИМОСТЬЮ В ЖИДКОМ СОСТОЯНИИ И ОТСУТСТВИЕМ РАСТВОРИМОСТИ В ТВЕРДОМ ДИАГРАММА СОСТОЯНИЯ ДЛЯ СИСТЕМ С НЕОГРАНИЧЕННОЙ РАСТВОРИМОСТЬЮ В ЖИДКОМ И ТВЕРДОМ СОСТОЯНИИ.
ДИАГРАММА СОСТОЯНИЯ ДЛЯ СИСТЕМ С ПРОЧНЫМ ХИМИЧЕСКИМ СОЕДИНЕНИЕМ.
17.Диаграммы
Учет в расчетах электронной проводимости твердых электролитов. Электроды сравнения в кислородных датчиках и определение равновесного парциального Поверхностное и межфазное натяжение, работа адгезии и когезии, адсорбция, уравнение адсорбции Гиббса,они определяются.кой сталирхностное натяжение,краевой угол смачиванияений, характеристики смачивания и растекания. Поверхностное натяжение или коэффициент поверхностного натяжения – величина, численно равная работе обратимого изотермического образования поверхности.
Чтобы увеличить или создать поверхность раздела фаз, нужно затратить работу.
РАБОТА АДГЕЗИИ – работа, затрачиваемая по разрыву двух
Если -стягивание капли
Идеальный газ. Уравнение состояния. Закон Дальтона. Реальные газы. Модель идеального газа 1.Молекулы (атомы)принимаются за материальные точки с определенной массой.Размеры их ничтожны по сравнению с расстоянием между ними. 2.Молекулы(атомы) находятся в состоянии непрерывного и постоянного движения.Между столкновениями они движутся прямолинейно. Движения равновероятны по всем направлениям. 3.Скорости частиц могут быть любыми. 4.При столкновении молекулы (атомы)ведут себя как упругие шары. Между частицами не действуют силы притяжения или отталкивания
V-молярный объём, R-молярная газовая постоянная.
давлений компонентов. Парциальное давление компонентов в смеси, это давление, которое он оказывает, занимая весь тот объем, что и смесь, при той же температуре. При повышении плотности изменяются свойства газов – они перестают быть идеальными. Простейшим уравнением, которое качественно правильно описывает отличие реального газа от идеального, является уравнение Ван-дер-Ваальса
3. Внутренняя энергия и энтальпия. Первый закон термодинамики. Характеризует общий запас энергии системы, включает все виды движения и взаимодействия частиц, составляющих систему. Так, внутренняя энергия U тела складывается из кинетической энергии движущихся молекул и потенциальной энергии, т.е. энергии взаимного притяжения и отталкивания частиц (молекул). Во внутреннюю энергию также входят: энергия электронов, ядерная энергия и т.д. Внутренняя энергия U системы (тела) должна зависеть от температуры Т (кинетическая энергия молекул) и от объема V, так как потенциальная энергия – энергия взаимного притяжения и отталкивания, зависит от расстояния между молекулами.
Внутренняя энергия не может равняться нулю (нет веществ без движения). Она всегда положительна и тем больше, чем больше движение. 2. Внутренняя энергия изолированной системы всегда остается постоянной величиной, независимо от протекающих в системе процессов. 3. Внутренняя энергия складывается из отдельных видов энергии, которые превращаются друг в друга в строго эквивалентных количествах. 4. Внутренняя энергия является однозначной функцией состояния системы, т.е. каждому состоянию системы соответствует одно значение внутренней энергии. Абсолютное значение внутренней энергии системы определить невозможно, но в термодинамике это и не нужно. Достаточно знать изменение внутренней энергии при переходе системы из одного состояния в другое. Первый закон термодинамики является обобщением закона сохранения и превращения энергии для термодинамической системы. Он формулируется следующим образом: Изменение ΔU внутренней энергии неизолированной термодинамической системы равно разности между количеством теплоты Q, переданной системе, и работой A, совершенной системой над внешними телами.
|
||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-08-01; просмотров: 326; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.108 (0.007 с.) |

 Уравнение ид газа:
Уравнение ид газа: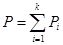 Закон Дальтона. Общее давление смеси идеальных газов равно сумме парциальных
Закон Дальтона. Общее давление смеси идеальных газов равно сумме парциальных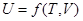 Потому
Потому


 - Al2O3 (рассмотреть превращения при охлаждении и кристаллизации расплава), Fe – O (области смесей, растворов, назвать последовательно все фазы, существующие в данной системе при определенной температуре).
- Al2O3 (рассмотреть превращения при охлаждении и кристаллизации расплава), Fe – O (области смесей, растворов, назвать последовательно все фазы, существующие в данной системе при определенной температуре).



 Поверхностное натяжение характеризует прочность межчастичных связей (как и)
Поверхностное натяжение характеризует прочность межчастичных связей (как и)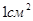
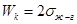 РАБОТА КОГЕЗИИ - это работа, затраченная против сил межчастичного взаимодействия при обратимом изотермическом разрыве столба однородной жидкости сечением, равным, то есть это работа по созданию двух новых единиц поверхности.
РАБОТА КОГЕЗИИ - это работа, затраченная против сил межчастичного взаимодействия при обратимом изотермическом разрыве столба однородной жидкости сечением, равным, то есть это работа по созданию двух новых единиц поверхности. 1,2-жидкости.
1,2-жидкости. АДСОРБЦИЯ – это изменение поверхностного натяжения вещества под действием изменения состава поверхностного слоя.
АДСОРБЦИЯ – это изменение поверхностного натяжения вещества под действием изменения состава поверхностного слоя.

 В состоянии равновесия:
В состоянии равновесия: Если - растекание капли.
Если - растекание капли.


