Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Диаграмма состояния для сплавов с промежуточной фазойСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
К промежуточным фазам относятся все фазы, которые образуются в интервале концентрации между растворами на основе компонентов А и В. От граничных растворов на диаграмме состояния промежуточные фазы всегда отделены двухфазными областями. Промежуточные фазы бывают переменного и постоянного состава. Промежуточные фазы переменного состава – это фазы, имеющие сравнительно широкие области гомогенности и представляют собой твердые растворы Промежуточные фазы постоянного состава – это определенные химические соединения компонентов, для которых характерны очень узкие (практически отсутствующие) области гомогенности. На диаграмме состояния эти области изображаются вертикальными прямыми (ординатами). В последнем случае область существования промежуточной фазы изображается вертикальной линией. Рассмотрим один из возможных вариантов диаграмм состояния для сплавов, образующих эвтектическую смесь из чистых компонентов и химического соединения постоянного состава (рис. 11). Компоненты: вещества А и В. Характеристика диаграммы (см. рис. 11): оба компонента неограниченно растворимы в жидком состоянии; в твердом практически нерастворимы друг в друге и образуют химическое соединение постоянного состава АmBn. За исключением чистых компонентов и химического соединения все сплавы претерпевают эвтектическое превращение.
Рис. 9. Микроструктура и схематическое изображение пластинчатой (а), зернистой (б), игольчатой (в) и скелетной (г) эвтектик (х500) .
а б Рис. 10. Микроструктуры доэвтектического (а), и заэвтектического (б) сплавов системы Pb-Sb (x500) –
Рис.11. Диаграмма состояния с промежуточной фазой
Фазы: жидкость L, кристаллы (А), кристаллы (В), кристаллы АmBn. Точки: А′ – температура плавления и кристаллизации компонента А; В′ – температура плавления и кристаллизации компонента В; С′ – температура плавления и кристаллизации химического соединения АmBn; Е 1 и Е2 – точки эвтектики. Линии: А′Е1С′Е2В′ – ликвидус; А′D Е1F и G Е2K В′ – солидус (не касается осей температур и разрывается на ординате химического соединения). Линии DЕ1F и GЕ2K в то же время являются и эвтектическими линиями. Эвтектические равновесия для даннойсистемы представляет собой равновесие жидкости эвтектического состава LE1 с кристаллами (А) и АmBn при температуре t E1:
LE1 и равновесие жидкости эвтектического состава LE2 с кристаллами (В) и АmBn при температуре t E2: LE2 Для анализа фазовых превращений диаграмма состояния разбивается на две части по ординате химического соединения и далее по примеру, приведенному в подразделе 4.2. При этом химическое соединение рассматривается как компонент. Первичные кристаллы промежуточной фазы при среднем увеличение могут выглядеть в виде дендритов, ветви которых на плоскости шлифа видны как овальные или округлые зерна в виде многоугольников, пластин или игл (рис. 12 и 13)
Рис. 12. Схематическое изображение возможных вариантов структур первичных кристаллов промежуточных фаз с эвтектикой
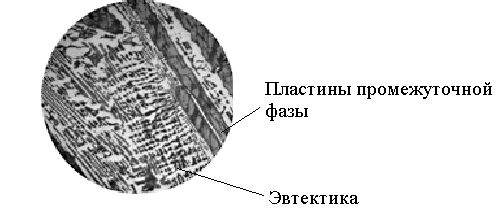
Рис.13. Микроструктура сплава Sb+30%Cu: избыточные кристаллы соединения Cu2Sb (темные пластины) и эвтектика (смесь кристаллов Cu2Sb и твердого раствора на основе Sb) в роли матрицы ПРАКТИЧЕСКАЯ ЧАСТЬ
ОБОРУДОВАНИЕ И ОБРАЗЦЫ Для выполнения лабораторной работы студентам предоставляются микроскоп и коллекция из 5 шлифов.
ЗАДАНИЕ 1. В соответствии с вариантом вычертить диаграмму состояния. 2. Указать компоненты, дать характеристику диаграммы, перечислить фазы, охарактеризовать точки и линии диаграммы. 3.Записать фазовые превращения в сплавах, происходящие при постоянных температурах (нонвариантные реакции). 4.Обозначить фазы и структуры во всех областях диаграммы. 5. В соответствии с вариантом задания для заданного сплава построить кривые охлаждения с применением правила фаз и описать происходящие фазовые превращения. 6. В соответствии с вариантом задания для заданной температуры определить фазы, находящиеся в равновесии, их состав, процентную долю фаз (по правилу отрезков). 7. Изучить под микроскопом шлифы и определить тип структуры (твердый раствор; избыточные (первичные) кристаллы + эвтектика; одна эвтектика). 9. Составить отчет о работе.
МЕТОДИЧЕСКИЕ УКАЗАНИЯ Диаграмма состояния компонентов А и В представлена на рис. 14. Компоненты: вещества А и В. Характеристика диаграммы: оба компонента неограниченно растворимы в жидком состоянии; компонент В ограниченно растворим в компоненте А в твердом состоянии, компонент А практически не растворим в компоненте В в твердом состоянии; компоненты образуют химическое соединение AmBn переменного состава (β-фазу).
Фазы: жидкость L, α- твердый раствор, промежуточная фаза β- твердый раствор на базе химического соединения АmBn., практически чистый компонент (В). Точки: А′ – температура плавления и кристаллизации компонента А; В′ – температура плавления и кристаллизации компонента В; C ′ – температура плавления и кристаллизации химического соединения AmBn; Е1 и Е2 – точки эвтектик; D – точка предельной растворимости компонента В в А; F – точка предельной растворимости компонента А в AmBn; G – точка предельной растворимости компонента В в AmBn; S – точка предельной растворимости компонента В в А при комнатной
Рис. 14 Диаграмма состояния температуре; R – точка предельной растворимости компонента A в AmBn в при комнатной температуре; Q – точка предельной растворимости компонента B в AmBn в при комнатной температуре Линии: А′Е1C′E2В – ликвидус; АDE1FC′GE2KВ′ – солидус (отрезок КВ′ пересекает ось компонента В в точке В′); DS – линия сольвуса – линия предельной растворимости B в A; FR – линия сольвуса – линия предельной растворимости A в AmBn; G Q– линия сольвуса – линия предельной растворимости В в AmBn; DE1F и GE2K – линии эвтектических превращений. Нонвариантные эвтектические превращения для даннойсистемы: – при эвтектической температуре tE1 представляет собой равновесие жидкости эвтектического состава (LE1) с твердыми кристаллами α - и β- растворов LE1 = – при эвтектической температуре tE2 представляет собой равновесие жидкости эвтектического состава (LE2) с твердыми кристаллами β- раствора и практически чистым компонентом (В) LE2
|
||||||
|
Последнее изменение этой страницы: 2016-04-23; просмотров: 1643; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.133.116.50 (0.01 с.) |

 а
а 
 б
б 
 в
в 

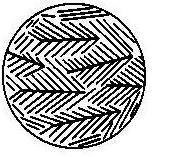 г
г

 (А)+ АmBn,
(А)+ АmBn, (B)+ АmBn
(B)+ АmBn