Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Кристаллография, кристаллизация, деформация и диаграммы состояния сплавовСодержание книги
Поиск на нашем сайте ЛЕКЦИИ По курсу МАТЕРИАЛОВЕДЕНИЕ
Конструкционные материалы Классификация по назначению 1) общего назначения; 2) пружинные; 3) износостойкие; 4) с особыми технологическими свойствами; 5) легкие; 6) с высокой удельной прочностью; 7) устойчивые к температуре среды. Свойства 1) механические (плотность, твердость); 2) технические (свариваемость, штампуемость); 3) эксплуатационные (устойчивость против коррозии); 4) физические (магнитные, объемные, электрические). Строение (структура) Влияние на строение: 1) изменение химического состава (чистые металлы или сплавы); 2) способ получения (отливка, поковка, выточка из прутка, порошковая технология); 3) способы обработки (пластическая деформация, термическая обработка, химикотермическая обработка).
ЧАСТЬ 1 Кристаллография, кристаллизация, деформация и диаграммы состояния сплавов Глава 1. Строение кристаллов
Кристаллы состоят из: ● молекул (H2O, CO2, …); ● ионов (NaCl, …); ● отдельных атомов (все Ме, нМе (Si, Gr, C, Ar)).
Виды взаимодействия частиц в кристаллах
1. Молекулярное взаимодействие (силы Ван-дер-Ваальса. Атомы инертных веществ)
● в основе такого взаимодействия лежит явление поляризации (образование диполей), следовательно, электростатического притяжения; ● каждая частица окружает себя соседями, значит, укладка плотная; ● все соседи равноценны, т.е. связь ненаправленная; ● энергия связи мала (Есв ~ 0,1 кДж/моль); ● диэлектрики с низкой tпл.
2. Обменное взаимодействие (ковалентное) Атомы IV и V групп: Si, Ge, C (4-валентные), Sb, Bi (5-валентные).
● в основе такого метода лежит обмен валентными электронами; ● число соседей точно известное и небольшое (3 или 4); ● соседи не равноценны, значит, связи направленные, Есв ~ 102 кДж/моль; ● очень твердые и очень хрупкие кристаллы; ● полупроводники и диэлектрики.
3. Ионное взаимодействие Ме + нМе Na – 1ē —> Na+ Cl + 1ē —> Cl- ● в основе взаимодействия лежит переход валентных электронов; ● число соседей большое; ● укладка плотная; ● связи ненаправленные, очень сильные, Есв ~ 102 кДж/моль; ● твердые кристаллы с высокой tпл; ● диэлектрики, полупроводники.
4. Металлическое взаимодействие Все Ме. ● в основе лежит коллектив электронов, это облако электронов связывает все свободные элементы; ● укладка наиплотнейшая; ●связи ненаправленные, Есв ~ 10 кДж/моль; ●все Ме пластичные, прочные, электропроводны.
Выводы: 1. Различные виды взаимодействия имеют одинаковую электростатическую природу. 2. При электростатическом взаимодействии преобладают либо силы притяжения, либо силы отталкивания в зависимости от расстояния между частицами.
Особенности расположения частиц в кристаллах
1. При электростатическом взаимодействии наиболее устойчивое положение занимает частица на определенном расстоянии а (когда Fпр = Fот), следовательно, расположение частиц в кристаллах должно быть регулярным. 2. При регулярном расположении части энергия межатомного взаимодействия будет минимальной. Кристаллы будут находиться в равновесии. 3. При любом смещении частицы от положения равновесия на ∆а на нее начинает действовать Fрезультир., значит, потенциальная энергия увеличивается на ∆W. ∆W = ∆а ● Fрезультир. Кристалл будет находиться не в равновесии. У смещенных частиц будет более сильная межатомная связь, их труднее разорвать. 4. Регулярно расположенные частицы в пространстве образуют правильную кристаллическую решетку, но способ укладки у каждого вещества строго индивидуальный, значит, индивидуальны свойства.
Глава 2. Особенности строения реальных кристаллов
В реальных кристаллах расположенные частицы не являются строго регулярными, т.к. в решетке есть дефекты и атомы разных компонентов.
Строение сплавов
Сплавы – все, что состоит из сплавов кристаллов. Фаза – обособленная часть сплава, имеющая собственное строение, состав, свойства. Фазы бывают двух видов – твердые растворы и промежуточные фазы.
1. Твердые растворы
Это фазы, при образовании которых атомы В расположен в решетке атомов А – решетке растворителя. Всегда переменный состав.
Твердые растворы бывают:
1) растворами замещения, атомы В стоят в узлах вместо атомов А.
Условие для твердых растворов замещения: если 2) растворами внедрения, когда атомы В стоят между узлами или в порах атомов А.
Условие для твердых растворов внедрения: RB ≤ 0,59RA. Например, Rпоры ГЦК ≤ 0,41RA, Rпоры ОЦК ≤ 0,29RA.
Вывод: вблизи любого растворенного атома решетка искажена, поэтому они вносят дополнительное упрочнение.
σ0 – упрочнение растворителя;
х – процент атомов В.
Аксиома: любой твердый раствор всегда прочнее растворителя. Также прочны твердые растворы внедрения.
2. Промежуточные фазы
Имеют собственную кристаллическую решетку, отличную от решеток А и В, обозначаются АnВn (фаза постоянного состава), ω (фаза переменного состава). Есть два класса: 1. Ме-Ме. Пример: ● Электронные фазы l/n (3/2, 21/13, 7/4), где l – число валентных электронов, n – число атомов, например, CuZn, Cu5Zn8, CuZn3; ● Фазы Лавеса А2В, если RB>>RA (20%), например, Fe2Mo.
2. Ме-нМе. Пример: FeO, FeS; Cr23C6, TiC, W2C – карбиды; Fe2N, Fe4N – нитриды; Супертвердые вещества.
Вывод: если промежуточная фаза образуется, то связи А с В сильнее, чем А-А и В-В, значит, связи будут более прочные, как правило прочнее, чем А-А и В-В.
Реальные кристаллы всегда имеют искаженную решетку. Чем выше суммарное искажение, тем кристаллы будут прочнее. Но одновременно будет ниже пластичность, электропроводность, хуже электропроницаемость, магнитные свойства, коррозионная стойкость.
Структура: 1. Макроструктура (визуально) – изломы, трещины. 2. Микроструктура (оптический микроскоп, увеличение до 2000 раз, видны частицы фаз). 3. Тонкая структура (электронный микроскоп, увеличение до 1000000 раз, видны дефекты).
ЧАСТЬ 2
Структурный анализ ДС
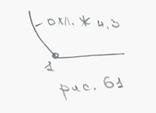
Сплавы с содержанием (0 – 2.14)% С
Превращение перитектическое, С = К+1-Ф = 0 Для того, чтобы из 2-х фаз получилась одна необходимо, чтобы было равное соотношение фаз
Если пропорция нарушена, то одна из фаз в избытке.
После затвердевания кристаллизуются все сплавы с содержанием С до 2.14%, состоят они из 1 фазы аустенита.
Ледебуриты: Крайне хрупкая структура, состав сплавов:
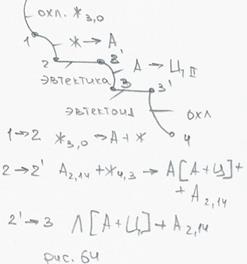
Сплавы с содержанием (2.14 - 6.69)% С Все сплавы после завершения кристаллизации состоят из 2-х фаз А+Ц и все в структуре содержать эвтектику ледебурит. !!! Наличие или отсутствие хрупкой эвтектики изменяет свойства сплавов и служит признаком для классификации этих сплавов на стали и чугуны. Стали содержат С < 2.14%, не содержат эвтектику, чугуны содержат С 2.14 – 6.69%, содержат эвтектику.
● SE – линия переменной растворимости углерода в аустените. Уменьшается от 2.14 до 0.8 при понижении температуры. Из аустенита должен выделяться ЦII;
● DQ – линия переменной растворимости углерода в феррите. При понижении температуры уменьшается от 0.02 до 0.006. Из феррита должен выделиться ЦIII;
● PSK
(●) S Эвтектоидное превращение. Перлит. С = 2+1-3 = 0! Ф ~ 87%, Ц ~ 13%, НВ = 2000 МПа, σВ ~ 850 МПа, δ ~ 15% Заключение: При переходе через линию PSK весь имеющийся в сталях и чугунах аустенит превращается в перлит.
Основная фаза феррит, в структуре нет перлита.
Стали: С (0.02 – 2.14)%, фазы феррит и цементит, Ф >> Ц, в структуре всегда есть перлит.
Чугуны: С (2.14 – 6.69)%, фазы феррит и цементит, Ц ≥ Ф, в структуре всегда есть ледебурит. Из-за огромного количества цементита чугуны по цвету излома называются белыми. Пример:
Чугуны
Белые чугуны в технике применить нельзя, т.к. они хрупкие, литейные их качества высокие. Если не устраивают их свойства – меняют структуру. Хрупкость возникает из-за того, что много цементита. Идея: Fe3C разложить на Fe (Ф) и С (графит), т.е графитизировать.
Доэфтектический чугун: П [ Ф+Ц] + ЦII + Л [Л [Ф+Ц] +Ц] - частичная графитизация, П + графит; - полная графитизация, Ф + графит (хрупкая фаза)
Графитизация чугунов
I способ – введение Si при выплавке (в присутствии кремния цементит либо не образуется, либо его очень мало).
I – белые чугуны П + Ц + Л[П+Ц], Si мало. II – половинчатые П + графит + Ц. III – перлитные [П+графит] IIIа – феррито-перлитные Ф + П + графит IIIб – ферритные Ф + графит. III – серые маркировки, СЧ-45 IIIа – СЧ-25 IIIб – СЧ-15 – самые не прочные.
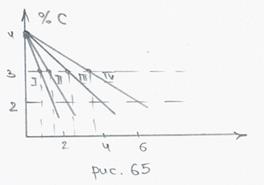
Свойства серых чугунов зависят от структуры основы – чем больше кремния, тем полнее графитизация, тем прочность меньше. Также свойства зависят от размера, формы графитовых включений.
(1) – графитовые крупные пластинки, наименьшая пластичность, применяют для производства станин; (2) – графитовые мелкие пластинки – модифицированные, применяют для производства зубчатых колес и корпусов. Соотношение Si-Ca (0.3 – 0.6)%; (3) – графит шаровидный – модифицирование – Mg ~ (0.02 – 0.08)%, самый пластичный, применяют для производства коленчатого вала.
Высокопрочные чугуны ВЧ _ _ (σВ/σU)-_(δ) – старая маркировка; ВЧ _ _ (σВ/σU) – старая маркировка.
Недостаток: из-за Si ухудшаются линейные качества (жидкотекучесть) чугуна. Для тонкостенных отливок серые чугуны не применяют.
II способ – применение специальной термической обработки (отжига).
Отжиг белого чугуна на ковкий: I – форма графита. Графитовые хлопья – компактные КЧ _ _ (σВ/σU) [кг/мм2]-_(δ) КЧ-35-10, КЧ-60-3.
Недостаток: длительность процесса.
ЛЕКЦИИ По курсу МАТЕРИАЛОВЕДЕНИЕ
Конструкционные материалы Классификация по назначению 1) общего назначения; 2) пружинные; 3) износостойкие; 4) с особыми технологическими свойствами; 5) легкие; 6) с высокой удельной прочностью; 7) устойчивые к температуре среды. Свойства 1) механические (плотность, твердость); 2) технические (свариваемость, штампуемость); 3) эксплуатационные (устойчивость против коррозии); 4) физические (магнитные, объемные, электрические). Строение (структура) Влияние на строение: 1) изменение химического состава (чистые металлы или сплавы); 2) способ получения (отливка, поковка, выточка из прутка, порошковая технология); 3) способы обработки (пластическая деформация, термическая обработка, химикотермическая обработка).
ЧАСТЬ 1 Кристаллография, кристаллизация, деформация и диаграммы состояния сплавов
|
||||||||
|
Последнее изменение этой страницы: 2016-04-19; просмотров: 373; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.214 (0.011 с.) |






 < 7-8% и решетки одинаковы, то растворимость неограниченна, если
< 7-8% и решетки одинаковы, то растворимость неограниченна, если 
 , где
, где - дополнительное упрочнение;
- дополнительное упрочнение;