
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Кафедра «Металловедение, порошковая металлургия, наноматериалы»Содержание книги
Поиск на нашем сайте
Кафедра «Металловедение, порошковая металлургия, наноматериалы»
РАЗБОР ДИАГРАММ СОСТОЯНИЯ ДВОЙНЫХ СПЛАВОВ
Методические указания к лабораторной работе
Самара 2012
УДК 669.017 Составители: Т.М. Пугачёва, Е.А.Якубович Разбор диаграмм состояния двойных сплавов: Метод. указ. к лаб. работам / Самарс гос. техн. ун-т., Сост. Т.М. Пугачёва, Е.А.Якубович. Самара, 2011. 38 с.
Рассматриваются типичные диаграммы состояния двухкомпонентных металлических систем и методика их разбора Методические указания предназначены для студентов направления 150600 – Материаловедение и технология новых материалов; специальности 110500 – Металловедение и термическая обработка металлов;110800 – Порошковая металлургия, композиционные материалы, покрытия.
Библиогр.:4 назв., рис 20
Печатается по решению методического совета ФТФ СамГТУ
Цель работы – научиться пользоваться диаграммами состояния двухкомпонентных металлических систем: определять фазы и структуры в сплавах, анализировать превращения при изменении температуры.
ТЕОРЕТИЧЕСКАЯ ЧАСТЬ Диаграммы состояния представляют собой графическое изображение равновесного фазового состояния сплавов в зависимости от температур и состава. Диаграммы состояния или диаграммы фазового равновесия строят в координатах температура (ось – ординат) – концентрация компонентов в сплаве (ось – абсцисс). Каждая точка на диаграмме состояния (фигуративная точка) показывает состояние сплава данной концентрации при данной температуре. Каждая вертикаль соответствует изменению температуры определенного сплава. Изменение фазового состояния отмечается на диаграмме точкой. Точки фазовых превращений называют критическими точками. Линии, соединяющие критические точки аналогичных превращений, разграничивают на диаграмме области аналогичных фазовых состояний. Диаграммы состояния строят для равновесных или близких к ним условий. Равновесное состояние соответствует минимальному значению свободной энергии и может быть достигнуто только при очень малых скоростях охлаждения или нагрева. Истинное равновесие в реальных условиях достигается редко. Однако знание диаграмм фазового равновесия является исходным моментом при рассмотрении процессов, протекающих неравновесно, т.е. метастабильно.
Диаграммы состояния дают возможность предсказать фазовые превращения сплава при изменении температуры и содержания компонентов: переход из жидкого состояния в твердое (кристаллизация), процессы перекристаллизации в твердом состоянии и прочие превращения. По ним можно определять вид термообработки, применимой для того или иного сплава, и наиболее рациональные температурные режимы термообработки и нагрева для горячей обработки давлением. ПРАВИЛО ФАЗ Общие закономерности равновесных превращений и сосуществования устойчивых фаз могут быть оценены с помощью правила фаз или закона Гиббса. Правило фаз устанавливает математическую зависимость между числом степеней свободы С, числом компонентов К и числом фаз Ф: С=К+2–Ф. Число степеней свободы С (или вариантность системы) показывает число внешних и внутренних факторов (температура, давление, концентрация), которые можно изменять без изменения числа фаз в системе В том случае, когда все превращения в системе происходят при постоянном давлении, уравнение правила фаз имеет следующий вид: С=К+1–Ф. За фазу принимают однородную часть сплава, отделенную от других частей границей раздела, при пересечении которой изменяется кристаллическая решетка, химический состав, свойства [1]. Компонентами называют вещества, образующие сплав и все фазы системы. При числе степеней свободы равном нулю: С=0 (нонвариантное равновесие) сплав из данного числа фаз может существовать только в совершенно определенных неизменяемых условиях: при постоянной температуре и определенном составе всех фаз, находящихся в равновесии. Изменение внутренних (состава фаз) или внешних (температуры) факторов вызывает изменение числа фаз. Если число степеней свободы равно единице: С=1 (моновариантное равновесие) или двум: C=2 (бивариантное равновесие), то возможно изменение в некоторых пределах соответственно одного или двух из факторов без изменения числа фаз.
СТРОЕНИЕ СПЛАВОВ В твердом состоянии в зависимости от характера взаимодействия компонентов могут образовываться твердые растворы (слабое взаимодействие) и химические соединения (сильное взаимодействие) и смеси (отсутствие взаимодействия).
Твердыми растворами называются кристаллические фазы, в которых атомы растворенного элемента размещаются в кристаллической решетке растворителя, либо замещая атомы в узлах решетки, либо внедряясь в междоузлия-поры. В первом случае кристаллы называют твердыми растворами замещения, во втором – твердыми растворами внедрения [2]. Как правило, твердые растворы имеют переменный состав. Твердые растворы сохраняют решетку атома-растворителя, при этом свойства твердых растворов могут заметно отличаться от свойств образующих его компонентов. Сплавы, состоящие из однородных твердых растворов, пластичны, хорошо прокатываются, куются, прессуются. Твердые растворы имеют высокое электросопротивление и низкий температурный коэффициент электросопротивления. Сплавы – твердые растворы, имеют низкие литейные свойства (плохая жидкотекучесть, склонность к ликвации, к образованию рассеянной пористости и трещин). Свойства химических соединений – высокая твердость, низкая вязкость. Кристаллическая решетка химического соединения отличается от кристаллических решеток компонентов, входящих в его состав, что обуславливает отличие свойств химического соединения от свойств компонентов. Лучшие литейные свойства в сочетании с хорошей обрабатываемостью резанием имеют сплавы со структурой эвтектической смеси. Они характеризуются наиболее низкой температурой плавления из всех сплавов системы, высокой жидкотекучестью, незначительной ликвацией. Для получения высоких литейных свойств концентрация компонентов в сплавах должна превышать их максимальную растворимость в твердом состоянии и приближаться к эвтектическому составу. При появлении эвтектики пластичность резко снижается. ТИПОВЫЕ ДИАГРАММЫ СОСТОЯНИЯ Вид диаграммы состояния зависит от того, какие фазы и по каким реакциям образуют компоненты в жидком и твердом состоянии. Из всего многообразия диаграмм рассмотрим следующие наиболее типичные [3, 4]: 1. Диаграмма состояния систем, образующих неограниченные твердые растворы. 2. Диаграмма состояния эвтектического типа с отсутствием растворимости компонентов в твердом состоянии. 3. Диаграмма состояния эвтектического типа с ограниченной растворимостью компонентов в твердом состоянии. 4. Диаграмма состояния для систем с промежуточной фазой.
Правило отрезков Чтобы в конкретном сплаве при заданной температуре определить концентрацию компонентов в фазах, через фигуративную точку, характеризующую состояние сплава, проводят коноду – горизонтальную линию до пересечения с линиями диаграммы, ограничивающими данную область. Проекции точек пересечение на ось концентраций показывают состав фаз. Отрезки между фигуративной точкой и точками, определяющими состав фаз, обратно пропорциональны количествам этих фаз. Например, для определения состава фаз при температурах t1, tK, t2 сплава N (см. рис. 1, а), через фигуративные точки 1, k, 2 проводим коноды. Проекции точек пересечения конод с линией ликвидус на ось концентраций показывают состав жидкой фазы (1, m, 2′), а точек пересечения с линией солидус(1′, n, 2) – состав твердой фазы. Как уже отмечалось, в процессе кристаллизации изменяется не только состав фаз, но и количественное соотношение между ними. Для определения массы или объемного количества твердой фазы необходимо вычислить отношение длины отрезка, примыкающего к составу жидкой фазы, к длине всей коноды; для определения количества жидкой фазы – отношение длины отрезка, примыкающего к составу твердой фазы, к длине коноды.
Например, при температуре tк, в рассматриваемом сплаве N процентное содержание жидкой и твердой фаз будет таким: · для жидкой фазы состава m (Lm): QLm · для твердой фазы состава n (αn): Qαn · относительное количество фаз определяется из соотношения: ПРАКТИЧЕСКАЯ ЧАСТЬ
ОБОРУДОВАНИЕ И ОБРАЗЦЫ Для выполнения лабораторной работы студентам предоставляются микроскоп и коллекция из 5 шлифов.
ЗАДАНИЕ 1. В соответствии с вариантом вычертить диаграмму состояния. 2. Указать компоненты, дать характеристику диаграммы, перечислить фазы, охарактеризовать точки и линии диаграммы. 3.Записать фазовые превращения в сплавах, происходящие при постоянных температурах (нонвариантные реакции). 4.Обозначить фазы и структуры во всех областях диаграммы. 5. В соответствии с вариантом задания для заданного сплава построить кривые охлаждения с применением правила фаз и описать происходящие фазовые превращения. 6. В соответствии с вариантом задания для заданной температуры определить фазы, находящиеся в равновесии, их состав, процентную долю фаз (по правилу отрезков). 7. Изучить под микроскопом шлифы и определить тип структуры (твердый раствор; избыточные (первичные) кристаллы + эвтектика; одна эвтектика). 9. Составить отчет о работе.
МЕТОДИЧЕСКИЕ УКАЗАНИЯ Диаграмма состояния компонентов А и В представлена на рис. 14. Компоненты: вещества А и В. Характеристика диаграммы: оба компонента неограниченно растворимы в жидком состоянии; компонент В ограниченно растворим в компоненте А в твердом состоянии, компонент А практически не растворим в компоненте В в твердом состоянии; компоненты образуют химическое соединение AmBn переменного состава (β-фазу). Фазы: жидкость L, α- твердый раствор, промежуточная фаза β- твердый раствор на базе химического соединения АmBn., практически чистый компонент (В). Точки: А′ – температура плавления и кристаллизации компонента А; В′ – температура плавления и кристаллизации компонента В; C ′ – температура плавления и кристаллизации химического соединения AmBn; Е1 и Е2 – точки эвтектик; D – точка предельной растворимости компонента В в А; F – точка предельной растворимости компонента А в AmBn; G – точка предельной растворимости компонента В в AmBn; S – точка предельной растворимости компонента В в А при комнатной
Рис. 14 Диаграмма состояния температуре; R – точка предельной растворимости компонента A в AmBn в при комнатной температуре; Q – точка предельной растворимости компонента B в AmBn в при комнатной температуре Линии: А′Е1C′E2В – ликвидус; АDE1FC′GE2KВ′ – солидус (отрезок КВ′ пересекает ось компонента В в точке В′); DS – линия сольвуса – линия предельной растворимости B в A; FR – линия сольвуса – линия предельной растворимости A в AmBn; G Q– линия сольвуса – линия предельной растворимости В в AmBn; DE1F и GE2K – линии эвтектических превращений. Нонвариантные эвтектические превращения для даннойсистемы: – при эвтектической температуре tE1 представляет собой равновесие жидкости эвтектического состава (LE1) с твердыми кристаллами α - и β- растворов LE1 = – при эвтектической температуре tE2 представляет собой равновесие жидкости эвтектического состава (LE2) с твердыми кристаллами β- раствора и практически чистым компонентом (В) LE2 Кривая охлаждения Для сплава N – N строим кривую охлаждения (рис. 16, б). До точки 1 охлаждение жидкости. В точке 1 - начало кристаллизации: из расплава образуются кристаллы β -фазы. При охлаждении от точки 1 до точки 2 протекает кристаллизация из-за выделения скрытой теплоты превращения темп охлаждения замедляется. В точке 2 кристаллизация заканчивается эвтектическим превращением, которое происходит при постоянной температуре. В этой связи на кривой охлаждения появляется горизонтальная площадка 2-2′. По завершении эвтектического превращения охлаждение сплава возобновляется и сопровождается выделением из α -фазы кристаллов β II- твердого раствора. На кривой охлаждения сплава N будет два перегиба и одна горизонтальная площадка (см.рис. 16,,). Определение состава и процентной доли фаз, находящихся в равновесии при температуре t3 При заданной температуре t3 в сплаве N (фигуративная точка k) в равновесии находятся α- и β- твердые растворы. Для определения состава фаз проведем коноду mn. Проекция точки m покажет состав -фазы, а точки n – β -фазы. Процентные доли α - и β -фазы определятся из соотношений: Q αm Qβn СОДЕРЖАНИЕ ОТЧЕТА 1. Указать цель работы. 2. Привести теоретические сведения о строении сплавов, фаз и диаграммах состояния при различном взаимодействии компонентов. 3. Выполнить задание в последовательности, указанной в примере. 4. Изучить шлифы. Схематично зарисовать структуры, используя рис.2, 7, 9, 12. 5. Сделать выводы по работе.
КОНТРОЛЬНЫЕ ВОПРОСЫ 1. Что такое фигуративная точка? 2. Какие точки называют критическими? 3. Что такое фаза? 4. Что такое компонент? 5. В каких координатах строится диаграмма состояния? 6. Какое состояние называют равновесным? 7. Какую информацию дает диаграмма состояния? 8. Приведите правило фаз. 9. Каковы характерные свойства сплавов – твердых растворов? 10. Каковы характерные свойства химических соединений?
11. Каковы характерные свойства сплавов эвтектического состава? 12. Начертите диаграмму состояния для сплавов с неограниченной растворимостью компонентов в жидком и твердом состояниях. Запишите фазовые превращения при охлаждении сплавов, постройте кривую охлаждения. 13. Какая линия называется ликвидус, солидус? 14. Как определяется концентрация фаз в двухфазных областях диаграммы? 15. Как определить количественное соотношение фаз в двухфазны областях диаграммы? 16. Что такое эвтектика? 17. Приведите уравнение эвтектической реакции.
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Фетисов Г.П. и др. Материаловедение и технология металлов: Учеб. для вузов. М: Высшая школа, 2006.–862 с. 2. Арзамасов Б.Н. и др. Материаловедение: Учебник. М.: МГТУ, 2005.– 646 с. 3. Захаров А.М. Диаграммы состояния двойных и тройных систем. М.: Металлургия, 1990.–240с. 4. Гуляев А.П. Металловедение. М.: Металлургия. 1966. С. 169-205. ПРИЛОЖЕНИЕ A Варианты заданий
Кафедра «Металловедение, порошковая металлургия, наноматериалы»
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-23; просмотров: 945; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.15.205.161 (0.012 с.) |


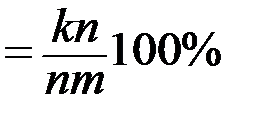 ;
; 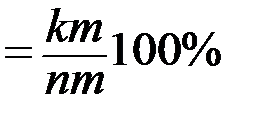 .
.

 αD+ βF;
αD+ βF; (В)+ βF.
(В)+ βF.



