
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Виробництво сірчаної кислотиСодержание книги
Поиск на нашем сайте
Сировиною для виробництва сірчаної кислоти є сірка, сірковий колчедан та сірководень, спалюючи які одержують оксид сірки (IV) SO Схему одержання сірчаної кислоти наведено на рис. 1. Сірчаний колчедан подають стрічковим конвейєром до бункера, а потім до печі, в яку безперервно вдувається повітря. Температура в печі повинна бути на менш ніж 800 °С. Хімічна промисловість випускає тисячі хімічних продуктів, один з яких — сірчана кислота — відіграє важливу роль. Завдячуючи її властивостям, а також у зв'язку з тим що вона значно дешевша інших кислот, сірчану кислоту широко використовують як в хімічній промисловості, так і в металообробній, нафтопереробній та в інших галузях промисловості (виробництво мінеральних добрив, синтез барвників і лікарських речовин, металургія, виробництво солей та кислот та ін.). Сірчану кислоту справедливо називають фундаментом хімічної промисловості. Сірчана кислота реагує з багатьма органічними сполуками. Цю властивість використовують для очищення бензину і гасу від шкідливих домішок, які утворюють з сірчаною кислотою сполуки, які не розчинюються в нафтопродуктах. Сірчану кислоту широко використовують в виробництві багатьох хімічних волокон, миючих засобів, вибухових речовин, барвників, її використовують для сушки газів, для очищення поверхні металів від окислів металів перед нікелюванням та іншими подібними процесами. Протягом двохсот років, які промайнули від початку промислового виробництва сірчаної кислоти, область її застосування змінилась. Обсяги виробництва сірчаної кислоти безперервно зростають. Формула сірчаної кислоти H
Рис. 10.7. Виробництво сірчаної кислоти
Солі сірчаної кислоти (Na H Сировина для виробництва сірчаної кислоти. Сірку відносять до числа найбільш розповсюджених хімічних елементів. Відомі великі родовища самородної сірки, сірчаного колчедану FeS Сірчану кислоту отримують з оксиду сірки, що є відходом виробництва багатьох відомих металів. При виробництві міді відходом є руда, містить сірчаний колчедан FeS Перша стадія виробництва сірчаної кислоти — отримання окису сірки (IV) Першою стадією виробництва сірчаної кислоти з сірки, сірчаного колчедану та сірководню є їх обпалювання для отримання газу оксиду сірки (IV). 4FeS Сірчаний колчедан подають стрічковим конвейєром до бункера, а потім до печі, в яку безперервно вдувається повітря. Огарок частково відноситься пічним газом, частково відводиться через отвір в печі. Температура в печі повинна бути на менш ніж 800 °С, так як при більш високій температурі частинки твердого матеріалу починають спікатися і утворюють грудочки. Температуру регулюють, проводячи реакцію з деяким надлишком повітря. Окрім того поміщають в реакційний апарат трубки парового котла. Утворена водяна пара використовується для виробництва електроенергії, або для інших цілей. Сучасні потужні установки обладнані автоматично діючими і записуючими контрольно — вимірювальними апаратами, через які можна отримати всі необхідні дані. Оптимальний режим підтримується на основі даних цих приборів, автоматичними засобами, які, наприклад, можуть знизити температуру в зоні реакції, збільшити подачу повітря. Друга стадія — окислення оксиду сірки (IV) Оксид сірки (IV) потрібно окислити в окис сірки (VI): 2SO При 400 °С може окислюватись максимально 99,2% окису сірки (IV), при 600 °С — лише 73%. Для збільшення швидкості цієї реакції використовують в якості каталізатора (найбільш ефективного) окис ванадію (V). При обпалюванні ванадію отримують газову суміш, яка насичена пилом та отруйними речовинами. Цю газову суміш очищують циклотроном і електрофільтром. В циклотроні частинки пилу видаляються із газової суміші під дією відцентрової сили. Циклотрон складається з двох циліндрів, які вставлені один в другий. Газ поступає збоку в зовнішній циліндр і рухається зверху вниз по спіралі. Частинки пилу під дією відцентрової сили подають в конічну частину апарату, звідки вони і видаляються. Але в газі все ще залишаються найменші пилинки. В електрофільтрі під дією сильного електричного поля молекули газу іонізуються. Пилинки, які зіткнулись з іонами перевтілюють заряд, притягуючись до одного із електродів, розряджаються і осідають. В кінці кінців газ осушують, шляхом взаємодії з концентрованою H Сушильна вежа наповнена керамічними кільцями. Зверху до башти безперервно подається рідина, яка стікає вниз, утворюючи плівку на поверхні кілець. Знизу до вежі безперервно подається газ. В такій башті рідина і газ рухаються протитечійно. Кислота зв'язується з водою і тому ступінь сушіння газу високий. Очищений газ нагрівають до температури початку реакції. Доцільно використовувати теплоту окислення окису сірки (IV). Таке підігрівання газу відбувається в трубчастому теплообміннику. По трубкам проходить гарячий газ, а в міжтрубному просторі — протитечією нагріваємий. Окис сірки (VI), який утворився в контактному апараті, потрібно витягнути із газової суміші в якій об'ємна доля складає 7%, і отримати концентровану H H Реакція відбувається при температурі 300 °С. В якості реакційного апарату використовують башту з насадкою із з проти-вотечійним рухом газової суміші і поглинаючою окис сірки (VI) рідиною. При цьому миттєво утворюється пара сірчаної кислоти. Газова суміш виявляється перенасиченою пароподібною H відправляється на склад, а частина після розмішування повертається в башту для зрошення насадки.
|
||||
|
Последнее изменение этой страницы: 2016-04-21; просмотров: 544; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.72.55 (0.007 с.) |

 .
. . Сірчана кислота — рідина, яка не має кольору, важка (майже вдвічі важча за воду) і в'язка, як олія. При кімнатній температурі вона нелетка, тому не має запаху. Під час контакту з водою відбувається дуже сильне розігрівання. Концентрована сірчана кислота поглинає з повітря водяні пари. Тому її використовують для висушування речовин. Гази осушають, шляхом пропускання їх через промивні склянки з концентрованою сірчаною кислотою. При потраплянні на шкіру викликає сильні опіки.
. Сірчана кислота — рідина, яка не має кольору, важка (майже вдвічі важча за воду) і в'язка, як олія. При кімнатній температурі вона нелетка, тому не має запаху. Під час контакту з водою відбувається дуже сильне розігрівання. Концентрована сірчана кислота поглинає з повітря водяні пари. Тому її використовують для висушування речовин. Гази осушають, шляхом пропускання їх через промивні склянки з концентрованою сірчаною кислотою. При потраплянні на шкіру викликає сильні опіки.
 , RaSO
, RaSO  + 2НС1 (випадає осад).
+ 2НС1 (випадає осад).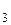 + 8SO
+ 8SO 


