
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Виды дефектов кристаллической решетки. Диаграмма прочность-плотность дефектов.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
4.1. Реальные кристаллы всегда содержат некоторое число дефектов кристаллической структуры. Появление дефектов в кристаллах неизбежно, поскольку они образуются уже в процессе выращивания монокристалла вещества. Их концентрация быстро возрастает с температурой, а также при деформировании кристалла. Различают два основных вида дефектов кристаллической решетки (рис. 1.10). Точечные дефекты создаются при внедрении в узлы и междоузлия идеальной кристаллической структуры "чужеродных" атомов, например, при приготовлении сплава (рис. 1.10, а и б). Кроме того, к точечным дефектам относятся вакансии, то есть, не заполненные атомами основного материала узлы кристаллической решетки. При этом атом основного материала может находиться рядом, в междоузлии кристаллической решетки (дефекты по Френкелю, рис. 1.10, в). Возможен случай, когда атом вообще может испариться из объема материала и вакансия является одиночной (дефекты по Шоттки, рис. 1.10, г). Точечные дефекты кристаллической решетки могут образовываться при бомбардировке поверхности кристалла ускоренными заряженными ионами различных веществ. Дефекты такого происхождения называютрадиационными дефектами.
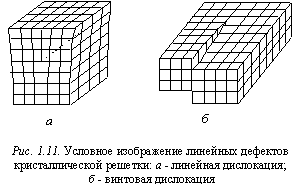
Другим видом дефектов кристаллической структуры являются дислокации. Дислокация - это линейный дефект, заключающийся в смещении плоскостей кристаллической решетки относительно друг друга. Различают два основных типа дислокаций:
линейная (краевая) дислокация представляет результат неполного сдвига кристаллической решетки. В итоге появляется незаконченная полуплоскость атомов (рис. 1.11, а); винтовая дислокация возникает вследствие полного сдвига некоторого участка решетки (рис. 1.11, б). Дислокации возникают как в процессе выращивания монокристаллов, так и в результате их механической и термической обработки. Границы кристаллитов в поликристаллических телах также имеют дислокационную природу. Выходы дислокаций на поверхность кристалла можно обнаружить по результатам травления кристалла в специальном травителе. В результате травления на поверхности кристалла появляются ямки травления, хорошо видимые под микроскопом. Плотность дислокаций оценивают визуально, подсчитывая под микроскопом число ямок травления на единице площади поверхности кристалла. Например, кристалл полупроводникового материала пригоден к дальнейшему использованию, если плотность дислокаций в нем не превышает 106107 м-2.
5. Строение металлических сплавов (химические соединения, твердые растворы, механические смеси). Под металлическим сплавом понимают вещество, получаемое сплавлением двух или более элементов с характерными металлическими свойствами. Металлические сплавы получают сплавлением элементов-металлов или металлов с неметаллами при преимущественном содержании металлов. Строение сплавов сложнее, чем чистых металлов. Твердый раствор — сплав, у которого атомы растворимого элемента размещены в кристаллической решетке растворителя. На микрошлифе твердого раствора кристаллы после травления выглядят совершенно одинаково. На рис. 21 представлена микроструктура твердого раствора цинка в меди. В кристаллах твердого раствора существует только один тип кристаллической решетки. Растворителем является тот элемент,кристаллическую решетку которого имеет твердый раствор. Растворимый элемент может либо замещать элемент-растворитель в узлах кристаллической решетки, либо располагаться в междоузлиях. По типу расположения атомов растворимого элемента в кристаллической решетке твердые растворы делят на две группы: замещения и внедрения. Металлы образуют химические соединения как с металлами, так и с неметаллами. Химическое соединение характеризуется определенной температурой плавления (диссоциации), скачкообразным изменением свойств при изменении состава. Химические соединения металлов с неметаллами образуются при строго определенных соотношениях входящих в них элементов, соответствующих нормальным валентностям. Атомы металлов в таких соединениях отдают свои валентные электроны неметаллам. Химические соединения металлов с неметаллами не обладают металлическими свойствами (например, А]203, FeO, NaCl и др.). Химические соединения между двумя металлами или металлом и элементом со свойствами, переходными между металлом и неметаллом, обладают металлическими свойствами. Химические соединения дают металлы, далеко стоящие друг от друга в периодической таблице элементов Д. И. Менделеева и сильно отличающиеся по свойствам. Металлические свойства у химических соединений выражены слабее, чем у чистых металлов и твердых растворов. Химические соединения имеют повышенную твердость и пониженную пластичность. 6. Диаграмма состояния и ее построение (метод термического анализа). Правило фаз. 6.1. Сущность термического метода построения диаграммы состояния сводится к определению критических температур при нагревании или охлаждении металлов и сплавов. Критическими называются температуры, при которых происходят фазовые превращения в сплаве (начало и конец кристаллизации, полиморфные превращения и другие). В процессе охлаждения сплава (рис.1) вначале скорость охлаждения велика, затем она уменьшается, т.к. происходит кристаллизация одной из фаз, при которой выделяется некоторое количество тепла.
При кристаллизации эвтектики происходит остановка охлаждения (площадка на кривой охлаждения), так как выделяемое тепло, в связи с кристаллизацией двух и более фаз одновременно, полностью компенсирует теплоотвод. При охлаждении сплавов с различным содержанием компонентов получают ряд кривых, изображающих ход процесса охлаждения сплава. Для двухкомпонентных систем при построении диаграмм по оси ординат откладывается температура, по оси абсцисс - концентрация элементов в сплаве (рис.2). Общее содержание компонентов в сплаве 100 %, и поэтому каждой точке на диаграмме соответствует определенное содержание компонентов. Критические температуры начала и конца кристаллизации, полученные при охлаждении сплавов, переносятся на координатные оси "температура-концентрация". Затем плавными линиями соединяются точки начала и конца кристаллизации сплавов. При наличии эвтектики в сплаве точки конца кристаллизации сплавов располагаются на одной прямой при температуре кристаллизации эвтектики (рис.4). Сплавы на, диаграмме состояния, располагающиеся до точки эвтектики (слева направо), называются доэвтектическими, соответствующие точке эвтектики - эвтектическими, располагающиеся за точкой эвтектики - заэвтектическими. Структура этих сплавов на примере системы Zn-Sn показана на рис.3.
6.2. Пра́вило фаз — соотношение, связывающее число веществ (компонентов), фаз и степеней свободы в гетерогенной системе Правило фаз записывается следующим образом:
где j — число фаз (например, агрегатных состояний вещества); v — число степеней свободы, то есть независимых параметров (температура, давление, концентрация компонентов), которые полностью определяют состояние системы при равновесии и которые можно менять без изменения числа и природы фаз; k — число компонентов системы — число входящих в систему индивидуальных веществ за вычетом числа химических уравнений, связывающих эти вещества. Иначе говоря, это минимальное количество веществ, из которых можно приготовить каждую фазу системы. n — число переменных, характеризующих влияние внешних условий на равновесие системы. При переменных давлении и температуре правило фаз сводится к выражению:
Иногда правило фаз записывают следующим образом:
то есть при равновесии число фаз в системе меньше либо равно числу компонентов плюс 2.
|
|||||||||
|
Последнее изменение этой страницы: 2016-04-19; просмотров: 1152; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.22.217.176 (0.011 с.) |


 4.2.
4.2.


 В случае однокомпонентной системы оно упрощается до:
В случае однокомпонентной системы оно упрощается до: ,Отсюда видно, например, что в однокомпонентной системе три фазы (j=3) могут сосуществовать при числе степеней свободы v, равном нулю, то есть при фиксированных давлении и температуре, что соответствует тройной точке на фазовой диаграмме. Две фазы (j=2) сосуществуют при произвольном измененнии либо давления, либо температуры, когда вторая из этих переменных не является независимой (v=1), то есть двухфазному равновесию на фазовой диаграмме соответствует линия. Если фаза одна (j=1), число степеней свободы системы равно двум, то есть температура и давление могут менятся независимо в пределах некоторой области на фазовой диаграмме — пока система не окажется на одной из линий двухфазного равновесия.
,Отсюда видно, например, что в однокомпонентной системе три фазы (j=3) могут сосуществовать при числе степеней свободы v, равном нулю, то есть при фиксированных давлении и температуре, что соответствует тройной точке на фазовой диаграмме. Две фазы (j=2) сосуществуют при произвольном измененнии либо давления, либо температуры, когда вторая из этих переменных не является независимой (v=1), то есть двухфазному равновесию на фазовой диаграмме соответствует линия. Если фаза одна (j=1), число степеней свободы системы равно двум, то есть температура и давление могут менятся независимо в пределах некоторой области на фазовой диаграмме — пока система не окажется на одной из линий двухфазного равновесия.



