
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
I. Одержання та властивості оксидівСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте Дослід 1.1. Одержання магній оксиду. В металічну ложку набирають трохи порошку магнію і запалюють
II. Одержання та властивості основ Дослід 2.1. Одержання магній гідроксиду. Білий порошок магній оксиду, отриманий у досліді 1.1, помістити у чашку з водою, розмішати та випробувати розчин індикатором. Звернути увагу на розчинність оксиду у холодній воді та зміну забарвлення індикатора. Які властивості розчину характеризує зміна його забарвлення?
Дослід 2.2. Одержання неорганічних основ. До розчинів магній сульфату, купрум сульфату та ферум (III) хлориду додати трохи розчину натрій гідроксиду. Відзначити забарвлення осадів.
Дослід 2.3. Амфотерні гідроксиди. У пробірку налити 2-3 мл розчину цинк сульфату і краплями внести розчин їдкого натру до отримання осаду. Суміш збовтати і разом з осадом розлити у дві пробірки. У першу пробірку додати розчин соляної кислоти, в другу – розчин лугу (до повного розчинення осадів).
III. Отримання та властивості солей Дослід 3.1. Одержання солі взаємодією металу з іншою сіллю. В пробірку з розчином меркурій (II) нітрату покласти мідну монету, а в другу пробірку з розчином цієї ж солі – гранулу цинку. Що з'являється на поверхні металів через деякий час? Написати рівняння реакцій і пояснити можливість їх протікання, користуючись рядом стандартних електронних потенціалів.
Дослід 3.2. Одержання нерозчинної солі взаємодією водних розчинів солей. У трьох пробірках випробувати дію розчинів: натрій хлориду на аргентум нітрат, натрій сульфату на барій хлорид, кальцій хлориду на натрій карбонат. Пояснити спостереження і написати рівняння реакцій.
Контрольні питання та вправи 1. Які з перелічених речовин реагують з калій гідроксидом: магній гідроксид, алюміній гідроксид, цинк оксид, ферум (III) гідроксид, барій гідроксид? Написати рівняння відповідних реакцій. 2. Які з вказаних сполук будуть попарно взаємодіяти: дифосфор пентоксид, натрій гідроксид, цинк оксид, аргентум нітрат, натрій карбонат, калій хлорид, хром (III) гідроксид, сульфатна кислота? Скласти рівняння відповідних реакцій. 3. Представити структури наступних речовин: барій гідрокарбонату, алюміній гідроксиду хлориду, ферум (III) нітрату, хром (III) гідроксиду сульфату, ферум (II) гідрогенсульфату, цинк гідроксиду сульфату, алюміній дигідрогенфосфату, ферум (III) гідроксиду карбонату, хром (ІІІ) гідрогенсульфату, кальцій фосфату, кальцій триоксосилікату, ферум (II) гідроксиду нітрату. 4. Скласти рівняння реакцій отримання усіма можливими способами наступних солей: купрум (II) сульфату, натрій нітрату, кальцій карбонату. 5. Змінюючи співвідношення реагуючих речовин за реакцією взаємодії кальцій гідроксиду з фосфатною кислотою, отримати кислу, основну та середню сіль. 6. Скласти рівняння реакцій отримання вказаних нижче солей: натрій гідрогенфосфату, барій гідрогенсульфату, алюміній дигідроксиду хлориду, хром (III) гідроксиду нітрату. Як перетворити ці солі в середні? Написати рівняння відповідних реакцій. 7. Скласти рівняння, за допомогою яких можна здійснити наступні перетворення: а) Fe(OH)3 б) Р в) Сu(ОН)2 г) Са(НСO3) д) Аl2O3
Література: 1. Скопенко В.В., Григор'єва В.В. Найважливіші класи неорганічних сполук: Навч. посібник. – К.: Либідь, 1996. – 152 с. 2. Ахметов Н.С. Общая и неорганическая химия: Учебник для химико-технологических вузов. – 2-е изд., перераб. и доп. – М.: Высш. шк., 1988. – С. 237-252. Лабораторна робота №3 “Реакції іонного обміну між розчинами електролітів.”
Мета: закріпити знання та вміння по темі “Іонні рівняння”.
Обладнання та реактиви: штатив з пробірками, розчини Na2CO3, BaCL2, CaCO3, ZnSO4, CuSO4, Fe2(SO4)3 , H2SO4 та HCl, NaOH, фенолфталеїн.
Теоретичні відомості
Усі хімічні процеси у водних розчинах електролітів, відбуваються на основі теорії електролітичної дисоціації. Теорія була запропонована шведським вченим Сванте Арреніусом у 1887 році. ТЕД містить три основні положення:
|
||
|
Последнее изменение этой страницы: 2016-04-18; просмотров: 734; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.216 (0.006 с.) |

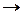 Fe2О3
Fe2О3 


