
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Схема кооперативного взаимодействия субъединиц в гемоглобинеСодержание книги
Поиск на нашем сайте
Присоединение в легких первой молекулы кислорода к одной из субъединиц гемоглобина изменяет ее конформацию. В результате она начинает влиять на следующую убъединицу, облегчая присоединение к ней кислорода. После этого они вдвоем влияют на третью субъединицу и так далее. В тканях первая молекула кислорода отделяется от своей субъединицы не очень легко, вторая уже быстрее и так далее. Дезоксиформа гемоглобина обозначается как Т-форма, напряженная (англ. tense), она обладает существенно более низким сродством к кислороду. Оксигенированная форма, или R-форма (англ. relaxed), обладает высоким сродством к кислороду.
Денатурация белков. Факторы, вызывающие денатурацию. Ренатурация. Денатурация Денатурация – необратимое осаждение белка из-за разрыва связей, стабилизирующих четвертичную, третичную, вторичную структуры белка, сопровождаемое изменением растворимости, вязкости, химической активности, снижением или полной потерей биологической функции. Физическая денатурация Вызывается повышением температуры, ультрафиолетовым и микроволновым излучением, механическими воздействиями, ионизацией заряженными частицами. Химическая денатурация Зависит от природы денатурирующего реагента: · кислоты и щелочи образуют водородные связи с пептидными группами, · органические растворители образуют водородные связи и вызывают дегидратацию, · алкалоиды образуют связи с полярными группами и разрывают систему водородных и ионных связей, · тяжелые металлы взаимодействуют с заряженными радикалами, нейтрализуют отрицательные заряды и разрывают систему водородных и ионных связей. На эффекте химической денатурации основаны устаревшие, но простые и наглядные тимоловая проба и проба Вельтмана, используемые ранее в клиникo-лабораторной диагностике для оценки состава белков крови. Классификация белков. Общая характеристика сложных белков. Классификация по функции В соответствии с биологическими функциями выделяют: · структурные белки (коллаген, кератин), · ферментативные (пепсин, амилаза), · транспортные (трансферрин, альбумин, гемоглобин), · резервно-пищевые (белки яиц и злаков), · сократительные и двигательные (актин, миозин, тубулин), · защитные (иммуноглобулины, тромбин, фибриноген), · регуляторные (соматотропный гормон, адренокортикотропный гормон, инсулин). Классификация по строению
Фибриллярные белки имеют соотношение осей более 10. Они состоят из пучков полипептидных цепей, спиралью навитых друг на друга и связанные между собой поперечными ковалентными и водородными связями. Выполняют защитную и структурную функции. Например: кератин, миозин, коллаген. По количеству белковых цепей в одной молекуле выделяют мономерные белки, которые имеют одну субъединицу (протомер) и полимерные белки, имеющие несколько субъединиц. Например, к мономерным белкам относятся альбумины, миоглобин, к полимерным - гемоглобин (4 субъединицы), ферменты лактатдегидрогеназа и креатинкиназа (4 и 2 субъединицы, соответственно), гексокиназа (2 субъединицы). Субъединицы в белке могут быть как одинакового, так и различного строения. Есть и более крупные белки. К ним относятся РНК-полимераза E.coli – 5 цепей, аспартаткарбамоилтрансфераза – 12 протомеров, глутаминсинтетаза – 12 протомеров, пируватдегидрогеназа – 72 белковых цепи. По химическому составу все белки подразделяют на простые и сложные. Простые белки содержат в структуре только аминокислоты (альбумины, глобулины, гистоны, протамины). Сложные белки, кроме аминокислот, имеют небелковые компоненты: o нуклеопротеины, o фосфопротеины, o металлопротеины, o липопротеины, o хромопротеины, o гликопротеины. Сложные белки - имеют белковую и небелковую (простетическую) части. Белковую часть составляет полипептид, построенный из АК-остатков. В состав небелковой части может входить: гем, металл, остаток фосфорной кислоты, углеводы, липиды и т.д.
|
||||
|
Последнее изменение этой страницы: 2021-07-18; просмотров: 92; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.137.219.213 (0.006 с.) |

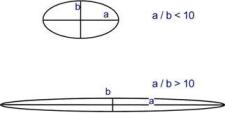 В зависимости от формы молекулы выделяют глобулярные и фибриллярные белки. В глобулярных белках соотношение продольной и поперечной осей составляет менее 10 и в большинстве случаев не более 3-4. Эти белки характеризуются компактной трехмерной укладкой полипептидных цепей. Например: инсулин, альбумин, глобулины плазмы крови.
В зависимости от формы молекулы выделяют глобулярные и фибриллярные белки. В глобулярных белках соотношение продольной и поперечной осей составляет менее 10 и в большинстве случаев не более 3-4. Эти белки характеризуются компактной трехмерной укладкой полипептидных цепей. Например: инсулин, альбумин, глобулины плазмы крови.


