Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Предмет и задачи биологической химии. Место биохимии среди других биологических наук.Содержание книги
Поиск на нашем сайте
Биохимия – это наука о химическом составе живой материи, химических процессах, происходящих в живых организмах, а также связи этих превращений с деятельностью органов и тканей. Главная задача биохимии состоит в том, чтобы достичь полного понимания на молекулярном уровне природы химических процессов, связанных с жизнедеятельностью клеток. Для её решения необходимо выделить из клеток многочисленные соединения, определить их структуру и установить их функции. (В качестве примера можно указать на многочисленные исследования, направленные на выяснение основ мышечного сокращения и ряда сходных процессов.) В итоге удалось выяснить ряд аспектов молекулярных основ мышечного сокращения. Важнейшие этапы в развитии биохимии. Биохимия и медицина. Роль отечественных ученых. 3. Белки - основа жизни. Физико-химические свойства белков: молекулярная масса, методы ее определения; размеры и форма белковой молекулы, устойчивость водных растворов, амфотерность.
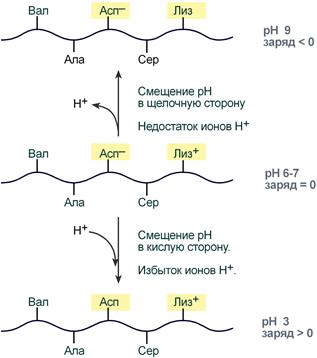
К физико-химическим свойствам белков относят амфотерность, растворимость, способность к денатурации, коллоидные свойства. Амфотерность Так как белки содержат кислые и основные аминокислоты, то в их составе всегда имеются свободные кислые (СОО–) и основные (NH3+) группы. Заряд белка зависит от соотношения количества кислых и основных аминокислот. Поэтому, аналогично аминокислотам, белки заряжаются положительно при уменьшении рН, и отрицательно при его увеличении. Если рН раствора соответствует изоэлектрической точке белка, то заряд белка равен 0. Если в пептиде или белке преобладают основные аминокислоты (лизин и аргинин), то при нейтральных рН заряд белка положительный, т.к. обусловлен положительным зарядом радикала этих аминокислот. Если в белке преобладают кислые аминокислоты (глутамат и аспартат), то белок кислый, при нейтральных рН заряд белка отрицательный и изоэлектрическая точка находится в кислой среде. Для большинства природных белков изоэлектрическая точка находится в диапазоне рН 4,8-5,4, что свидетельствует о преобладании в их составе глутаминовой и аспарагиновой аминокислот. Амфотерность имеет значение для выполнения белками некоторых функций. Например, буферные свойства белков, т.е. способность поддерживать стабильность рН крови, основаны на способности присоединять ионы Н+ при закислении среды или отдавать их при защелачивании.
С практической стороны наличие амфотерности позволяет разделять белки по заряду (электрофорез) или использовать изменение величины рН раствора для осаждения какого-либо известного белка. Наличие как положительных, так и отрицательных зарядов в белке обусловливает их способность к высаливанию, что удобно для выделения белков в нативной (живой) конформации. Влияние рН на заряд белка При смещении рН в растворе изменяется концентрация ионов Н+. При закислении среды (при снижении рН) ниже изоэлектрической точки ионы Н+ присоединяются к отрицательно заряженным группам глутаминовой и аспарагиновой кислот и нейтрализуют их. Заряд белка при этом становится положительным. При увеличении рН в растворе выше изоэлектрической точки концентрация ионов Н+ снижается и положительно заряженные группы белка (NH3+-группы лизина и аргинина) теряют протоны, их заряд исчезает. Суммарный заряд белка становится отрицательным.
Изменение заряда белковой цепи при изменении pH Растворимость
Так как большинство белков несет много заряженных групп, то в целом они водорастворимы. Растворимость объясняется: · наличием заряда и взаимоотталкиванием заряженных молекул белка, · наличием гидратной оболочки – окружение молекулы диполями воды и взаимодействие их с полярными и заряженными группами на поверхности глобулы белка. Чем больше полярных и/или заряженных аминокислот в белке, тем больше гидратная оболочка. Например, 100 г белка альбумина связывает 30-50 г воды.
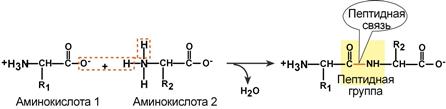
4. Первичная структура - основа биологических свойств и видовой специфичности белков. Пептидная связь, ее образование. Объединение аминокислот через пептидные связи создает линейную полипептидную цепь, которая называется первичной структурой белка Учитывая, что в синтезе белков принимает участие 20 аминокислот и средний белок содержит 500 аминокислотных остатков, то можно говорить о невообразимом количестве потенциально возможных белков. В организме человека обнаружено около 100 тысяч различных белков. К примеру, 2 аминокислоты (аланин и серин) образуют 2 пептида Ала-Сер и Сер-Ала; 3 аминокислоты дадут уже 6 вариантов трипептида; 20 аминокислот – 1018 различных пептидов длиной всего 20 аминокислот (при условии, что каждая аминокислота используется только один раз).
Самый большой из известных в настоящее время белков - титин - является компонентом саркомеров миоцита, молекулярная масса его различных изоформ находится в интервале от 3000 до 3700 кДа. Титин камбаловидной мышцы человека состоит из 38138 аминокислот. Первичная структура белков, т.е. последовательность аминокислот в нем, программируется последовательностью нуклеотидов в ДНК. Выпадение, вставка, замена нуклеотида в ДНК приводит к изменению аминокислотного состава и, следовательно, структуры синтезируемого белка.
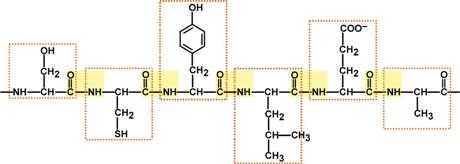
Участок белковой цепи длиной в 6 аминокислот (Сер-Цис-Тир-Лей-Глу-Ала) Если изменение последовательности аминокислот носит не летальный характер, а приспособительный или хотя бы нейтральный, то новый белок может передаться по наследству и остаться в популяции. В результате возникают новые белки с похожими функциями. Такое явление называется полиморфизм белков. Для многих белков обнаруживается ярко выраженный консерватизм структуры. Например, гормон инсулин у человека отличается от бычьего только на три аминокислоты, от свиного – на одну аминокислоту (аланин вместо треонина). Последовательность и соотношение аминокислот в первичной структуре определяет формирование вторичной, третичной и четвертичной структур.
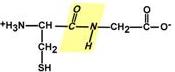
Пептидная связь – это связь между α-карбоксильной группой одной аминокислоты и α-аминогруппой другой аминокислоты.
К свойствам пептидной связи относятся: 1. Копланарность Все атомы, входящие в пептидную группу находятся в одной плоскости, при этом атомы "Н" и "О" расположены по разные стороны от пептидной связи.
|
||||||
|
Последнее изменение этой страницы: 2021-07-18; просмотров: 324; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.219.115.86 (0.009 с.) |