
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Коррозия серебра и его сплавовСодержание книги Похожие статьи вашей тематики
Поиск на нашем сайте
Серебро. Химический элемент, символ Ag, имеет порядковый номер 47, атомный вес 107,88, валентность I—II, плотность Ю,5 г/cмз, температура плавления 960,56С, твердость по Бриннеллю в отожженном состоянии 25 кгс/см2. 19
Серебро — металл белого цвета, хорошо провалит тепло h электрический ток, обладает очень высокой пластичностью и коз. костью, прекрасно полируется и имеет высокую отражательную способность. Серебро относится к группе благородных металлов. Взаимодействует: с азотной кислотой, с серной выше 50%; с горячей соляной кислотой; с аммиаком в присутствии кислорода. Царская водка не растворяет серебро вследствие образования на его поверхности нерастворимой пленки хлорида серебра. Чистая ледяная (уксусная) кислота не действует на серебро, но при добавлении небольшого количества соляной кислоты скорость реакции повышается. Серебро устойчиво в щелочах, кроме аммиака в присутствии кислорода. Слабые кислоты не взаимодействуют с серебром. В чистом воздухе серебро покрывается бесцветной пассивно,! пленкой. Сернистые соединения образуют па поверхности металла сульфаты и, сульфиды серебра, от светло-желтого до темно-коричневого цвета. Газообразный хлор вызывает образование ил поверхности белого хлорида серебра. Сплавы серебра, содержащие неблагородные металлы, покрываются также темной окисной пленкой, однако здесь коррозия происходит за счет образования сульфидов легирующих металлов.
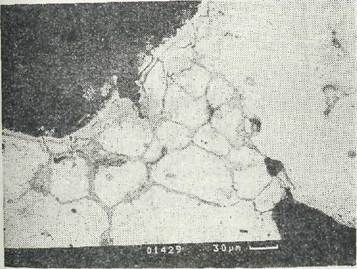
Археологическое серебро зачастую по внешнему виду трудно Находясь в почве, серебро может под действием хлора -преобразоваться в серое мягкое вещество хлорид серебра — «роговое серебро», имеющее низкую температуру плавления. Нередко археологическое серебро покрыто сернистыми соединениями в связи с образованием в почве сероводорода. Все археологическое серебро очень хрупкое в результате поражения межкристаллитной коррозией. Хрупкость обусловлена образованием -на границах зерен отдельных фаз из соединений <' хлором и продуктов коррозии легирующих" добавок. В результате ослабления межатомных сил между кристаллитами происходит ослабление механической прочности всего предмета (рис. 1) Химические свойства продуктов коррозии серебра Ag2S — сульфид серебра — восстанавливается до металлической 20 Рис. 1. Рис, 2-
3.3. КОРРОЗИЯ СПЛАВОВ ЗОЛОТА Золото. Химический элемент, символ Аи, порядковый номер 79, атомный вес 197, основная валентность III, плотность 19,3 г/см3, температура плавления 1063сС, твердость по Бринеллю в отожженном состоянии 18—20 кгс/мм 2. Золото имеет красивый желтый цвет и высокую отражатель ну го способность, обладает высокой пластичностью, проводит тепло и электрический ток. Золото относится к группе благородных металлов, обладает высокой химической стойкостью. Растворяется только в смеси соляной п азотной кислоты в соотношении 3 ; 1 («царской водке») с образованием зол отохлористоводородной кислоты и в растворах цианидов щелочных металлов. Сплавы золота с медью и серебром также очень устойчивы к воздействию атмосферных влияний. Археологическое золото более подвержено влиянию агрессивной среды «может быть поражено межкристаллитной коррозией. Причинойявляются легирующие добавки серебра и меди. Иногда золотые предметы, найденные в почве, имеют красный кристаллический налет трихло-рата золота AuCl3 которое разлагается при температуре 228°С. Сплавы золота с медью при нагревании темнеют вследствие окисления меди. Низкопробные сплавы золота с медью окисляются при взаимодействии с разбавленной азотной кислотой, а сплавы ниже 250 пробы растворяются в ней. 3.4. КОРРОЗИЯ ОЛОВА Олово. Химический элемент, символ Sn, имеет порядковый помер 50, атомный вес 118,7, валентность II, IV, плотность 7,298 г/см3, температура плавления 213,9°С, твердость по Бри-неллю 5 кгс/мм2. Олово имеет серебристо-белый цвет, пластично, проводит тепло и электрический ток. Олово полиморфнои может иметь различные модификации. Обычная B(«бета»)-модификация (белое олово; устойчива выше 13,2°С и «-модификация (серое олово), которое имеет атомную массу 118,7; плотность 5,85 г/см3, температуру плавления 232°С. Превращение белого олова в серый порошок ничего общего с коррозией не имеет и называется оловянной чумой. При поражении предмета оловянной чумой.на поверхности предмета образуются очаги рыхлого крупнокристаллического серого порошка, который при попадании на здоровый предмет вызывает заражение. Заражению, подвержены предметы из чистого олова. Более устойчивы - предметы из сплавов, олова со свинцом, серебром, сурьмой. Олово устойчиво на воздухе и в воде, т.к. покрывается тонкой окисной пленкой. В почве олово разрушается более активно, превращаясь в гидратированную окись, двуокись и окись. Олово легко растворяется в концентрированной соляной, азот-ной кислоте и царской водке. Медленно растворяется олово в концентрированной серной кислоте, щелочах и разбавленной азотной кислоте. Самой агрессивной из кислот по отношению к олову является щавелевая кислота. Так как олово относится к числy амфотерных элементов, в кислой среде оно образует соли типа SnSOi, SnСl2, где олово двухвалентно. В щелочной среде двухвалентное олово образует станниты, например Na2SnO2, а четырехвалентное — станнаты, например Na2SnОз. 3.5. КОРРОЗИЯ СВИНЦА С в и н е ц. Химический элемент, символ Ph. порядковый помер 82, атомный вес 207,21, основная валентность II, плотность 11,34 г/см3, температура плавления 327,4°С, твердость по Бри-неллю 4 кгс/мм2. Свинец имеет голубовато-белую окраску, очень мягкий и пластичный, проводит электрический ток. Пары и соли свинца ядовиты и могут привести к параличу дыхательных путей. На воздухе свинец покрывается темно-серым налетом окиси свинца РЬО, который предохраняет металл от дальнейшего разрушения. Под 'действием газов, содержащихся в загрязненной атмосфере, свинец корродирует с образованием карбоната свинца. Летучие органические кислоты являются катализаторами коррозии свинца. Сначала появляется белесый налет, который постепенно превращается в пористую массу, при этом происходит резкое увеличении предмета. Процесс корразии, начавшись с образования карбоната свинца, может проходить далее и присутствии Углекислого газа, причем органическая кислота восстанавливается и вновь используется. Предметы из свинца, пролежавшие длительное время в морской воде, покрыты белой коркой, состоящей из сульфата, карбоната и хлорида свинца. Предметы, пролежавшие длительное время в земле, помимо солей, иногда имеют коричневый слой окислов. Эти наслоения вполне устойчивы, в принципе они не причиняют вреда предмету, по сильно искажают его форму и делают его неприглядным.
Железо. Химический элемент, символ Fe, имеет порядковый номер 26, атомный вес 55,85, валентность II, III, плотность 7,87 г/см3, температуру плавления 1539°С, твердость гю Бринел. лю 60 кгс/мм2..Железо хорошо куется в холодном и нагретом состоянии, проводит электрический ток, обладает прекрасным л магнитными свойствами, имеет голубовато-белый цвет и доволь-но сильный блеск. Качество железа и его свойства зависят от присутствия в сплаве примесей и в основном от количества растворенного в нем углерода. Сплав, содержащий более 2% углерода, называется чу- гуном. Чугун тверже железа, хрупок, обладает хорошими литей- ными свойствами, имеет серый цвет и более низкую температуру плавления. Сплав, содержащий менее 2% углерода, называется сталью. Все сплавы железа относятся к черным металлам. На воздухе железо образует гидроокись Fe(OH)2, которая окисляется до гидроокиси Fe2O3 • Н2О. Рыжая ржавчина в атмосферных условиях состоит из обеих модификаций гидроокиси железа Х и У. При определенных условиях процесс идет дальше; если гидроокись теряет воду, то образуется окись железа Fe2O3 или закись - окись железа Fe3O4 — магнетит. Это чрезвычайно твердое и устойчивое соединение черного цвета может предохранять железо от дальнейшего разрушения, если находится на поверхности сплошным слоем. При попадании на поверхность железа из атмосферы современных промышленных городов агрессивных хлорсодержащих солей образуется хлористое FeCl2 и хлорное железо — FeCb, которые поглощают воду и дают нестойкие соединения. В почве железо интенсивно разрушается и степень коррозии зависит от влажности и состава среды. При высокой влажности доступ кислорода меньше, и железо окисляется меньше. Продукты почвенной коррозии железа очень разнообразны, которые отличаются по внешнему виду, цветом и механическими свойствa-ми. Лимонит — Fe2O3-nH2О — ржавчина желтовато-коричневого цвета; сернокислая соль железа — FeSO4-nH2O — бело-розового цвета; вивионит — Fe3(PO4)2 — синего цвета, который может предохранять предмет от дальнейшего разрушения. При корродировании железный предмет всегда значительно увеличивается в объеме, расслаивается по слоям сварки и ковки. Железо растворяется в кислотах: серная кислота действует на железо, достигая максимума,при 47% концентрации, поел;.1 чего уменьшается, в 98% кислоте железо не растворяется, в 100% кислоте реакция резко повышается; в соляной кислоте растворение железа слабее, чем в серной при одинаковых концентрациях;.холодная разбавленная азотная кислота (плотность до 1,034) 2} растворяет железо без выделения водорода, восстанавливаясь до аммиака, а до плотности 1,115 продуктами реакции являются афт и закись азота; серый чугун сильно корродирует в азотной кислоте; фосфорная кислота слабо растворяет железо вследствие образования фосфатной пленки; уксусная кислота действует на чугун; углеродистая сталь взаимодействует с плавиковой кислотой ЧРИ концентрации ниже 65%; чугун растворяется плавиковой кислотой любой концентрации; в органических кислотах, свободных от растворенного кислорода, железо устойчиво. Черные металлы стойки в разбавленных растворах щелочей. При повышенной температуре в присутствии хлоридов скорость коррозии возрастает.
ИССЛЕДОВАНИЕ
ПРЕДМЕТОВ ИЗ МЕТАЛЛОВ Для составления программ и методик реставрации проводят различные исследования. Программа исследований зависит от степени сохранности металла, который разделяется на: I. Предметы, имеющие хорошую сохранность, — новый металл с очагами локальной коррозии, небольшое общее загрязнение. 2. Предметы, имеющие удовлетворительную сохранность, новый металл: общее загрязнение, сплошная коррозия или патина, 3. Предметы, имеющие плохую сохранность, — новый и археологический металл: для нового металла характерны общие пыле-грязевые наслоения, сплошная коррозия с очагами рецидивов коррозии, межкристаллитная коррозия, значительная деформация, утраты; для археологического металла.характерны толстый слой коррозионных наслоений (возможна благородная патина), межкристаллитная коррозия, хрупкость, трещины, утраты, возможна сквозная коррозия; декор читается плохо, форма предмета сохраняется, металлическое ядро имеется. 4. Предметы с частично минерализованным металлическим яд 5. Предметы с полностью минерализованным металлических! В зависимости от поставленной задачи при исследовании предметов из металлов могут применяться следующие методы: 4.1 МЕТОД ВИЗУАЛЬНОГО ИССЛЕДОВАНИЯ Визуально возможно определить: состав Загрязнений, остатки почвы, очаги активной коррозии, толщину коррозионного слоя, состав коррозии, цвет металла, металл, технологию изготовления, следы ремонта, потертости, трещины, разрывы, утраты, клейма, надписи, покрытия, эмаль, пасты, остатки органики на археологических предметах и т. д. Метод световой микроскопии Детально продолжить исследования под увеличением позволяет метод световой микроскопии. При помощи микроскопа пли лупы при направленном освещении изучают фрагменты предмета. Этот метод также используется для проведения микрофотосъемок с помощью несложных приспособлений. 4.2. ХИМИЧЕСКИЕ МЕТОДЫ Метод микрохимического анализа позволяет определить качественный состав сплавов и неорганических веществ. Этот метод позволяет определить ионный состав исследуемого соединения. Для этого используется мокрый способ, т. е. исследования проводятся с веществами1, растворенными в воде, минеральных кислотах, щелочах. Реставратор, имея реактивы и несложное оборудование, может сам проводить простые анализы: Определение меди в сплаве. На очищенную поверхность исследуемого металла наносят каплю раствора азотной кислоты с водой в соотношении 1:1. Мосле начала реакции и газовыделения, каплю осторожно промокают фильтровальной бумагой. Далее бумагу помещают в пары аммиака и в случае, если сплав содержит медь, пятно.на бумаге окрасится в темно-голубой цвет. Определение бронзы и латуни (бронза -- сплав меди с оловом; латунь — сплав меди с цинком). Чтобы отличить бронзу от латуни, нужно поместить 0,05 г сплава в пробирку и добавить Ю мл азотной кислоты, разбавленной водой, в соотношении 1: 1 н накрыть часовым стеклом. После растворения основного количества металла жидкость необходимо выдержать па водяной бане при 95°С в течение 30 минут. Оловянистая бронза даст на дне белый осадок. Если сплав содержит цинк, раствор останется прозрачным. В случае, если сплав содержит одновременно олово и цинк, то Цинк в сплаве можно определить электрохимическим методом. К предмету присоединяют положительный полюс сухой батарейки. 27 Полоску фильтровальной бумаги, смоченной серной кислотой, кладут на поверхность предмета. Поверх бумаги накладывают па 16 секунд полоску меди, соединенную с отрицательным полюсом. Затем бумагу снимают, кладут на стекло и капают на нее аммиачным раствором тиоционата ртути. Если пятно приобрело окраску лилово-черного диета, то это указывает на присутствие цинка в сплаве. Определение никеля в сплаве. На поверхность металла наносят каплю разбавленной азотной кислоты (\: 1), выдерживают 10— 15 сек и снимают кусочком фильтровальной бумаги. Затем бумагу держат над парами насыщенного аммиака до тех пор, пока пятно не окрасится в темно-голубой цвет. Далее на нее капают I % раствором диметилглиоксима в спирте. Если пятно приобретет красный цвет, значит в сплаве присутствует никель. Определение олова в сплаве. Приготовить раствор из равных объемов насыщенного раствора сернистого газа и раствора 1:3 серной кислоты. На поверхность исследуемого металла наносят каплю этого раствора. При наличии олова в сплаве через несколько минут образуется желто-коричневое пятно, окруженное черным кольцам. Определение присутствия свинца в сплаве. На поверхность металла кладут кристаллики хромовой кислоты, сверху наносят каплю ледяной уксусной кислоты. Через минуту добавляют каплю воды. Вокруг кристаллов образуется желтый осадок хромата свинца. Определение сплава олово—свинец. Можно применять пробы как для олова, так и для свинца. Определение золотых сплавов. Дли того, чтобы отличить сплавы меди от сплавов золота, иногда очень схожих по цвету, необходимо провести химическую пробу на медь. Если разбавленная азотная кислота 1:1 не реагирует со сплавом, значит содержание золота в нем выше 26%. Определение наличия позолоты. В смеси азотной и соляной кислоты 1:3 (царская водка) растворяют стружку металла. Каплю раствора смешивают с каплей 5% соляной кислоты, добавляют каплю йодного раствора индикатора родамин В и помещают смесь в микро пробирку. Затем добавляют 8 капель бензола и смесь встряхивают. Если бензол окрасится в красный цвет, то это указывает па присутствие золота, что подтверждается оранжевой флуоресценцией под кварцевой лампой. Наличие золота в растворе можно определить действием капли этого раствора на фильтровальную бумагу, пропитанную раствором двухлористого олова. В этом случае образуется окрашенное пятно восстановленного золота. 28 Определение серебряного сплава. Различить серебряный сплав п даже провести количественный анализ можно с помощью «красной пробирной кислоты»: 3 г бихромата.калия; 3 см3 концентрированной серной кислоты; 32 см2 дистиллированной воды. На очищенную поверхность наносят каплю кислоты, при этом серебро переходит в сульфат, а затем в кроваво-красный бихро-мат серебра. По степени окраски можно с большой точностью определять содержание серебра в сплаве от 1000 до 600 пробы. Содержание серебра в сплаве ниже 250 пробы пробирной кислотой определить невозможно, сплав ведет себя как неблагородный. Присутствие серебра в сплаве в этом случае можно установить, действуя па одно и то же место азотной, а затем соляной кислотой. В этом случае образуется хлорид серебра, который вызывает помутнение капли. Молочное помутнение исчезает, если на это место подействовать аммиаком. Определение железа. Самым простым способом определения железа является действие на него магнитом. При исследовании археологических предметов возможно проявление магнитных свойств и у цветных сплавов, если рядом находился железный предмет. В результате электрохимических процессов соединения железа могут толстым слоем покрывать предмет и выделяться в виде самостоятельных фаз. Если сплав цветного металла имеет в своем составе железо, то он также может проявлять магнитные свойства.. При нагревании железа в солянй кислоте раствор окрашивается в желтый, цвет. Гравиметрический (весовой) и объемный анализы. Позволяют определить количественный состав неорганических веществ. В основе химических (методов количественного анализа лежат химические законы: закон эквивалентов и закон постоянства веществ. 4.3. ФИЗИКО-ХИМИЧЕСКИЕ МЕТОДЫ АНАЛИЗА Эмиссионный спектральный анализ. Позволяет определить качественный и количественный состав элементов в веществе. Основан на регистрации атомов эмиссионных спектров с помощью аппарата спектрографа. Рентгеновский микроспектральный (микрозондовый) анализ. Позволяет получить данные об элементах, входящих в состав вещества в широком диапазоне. Исследования проводят па спектральных растровых микроскопах. 29
Рентгенография и рентгеноскопия. Позволяет получить рентгеновские снимки предметов, а также увидеть под слоем коррозии подлинную форму предмета, декор, инкрустацию, позолоту, Широко применяется при исследовании археологических находок. Исследования проводят па рентгеновских установках и специальных установках, оборудованных видеоаппаратурой. Ультразвуковая дефектоскопия. Позволяет определить наличие пустот, раковин, трещин, расположенных внутри металла. Для этих целей служит аппарат ультразвуковой дефектоскоп. Определение магнитных свойств. С помощью магнита определяется железо и его сплавы. Этим же методом можно установить присутствие железа в цветных сплавах. Магнитом определяется наличие металлического ядра в археологических предметах ил железа. 4.5. ОПТИКО-ФИЗИЧЕСКИЕ МЕТОДЫ ИССЛЕДОВАНИЙ Металлография. Позволяет исследовать микроструктуру металла (шлифа), определить степень деструкции металла, природу межкристаллитной коррозии, состав сплава. Исследования проводят на простых металлографических аппаратах и специальных растровых (сканирующих) электронных микроскопах. В своей работе реставратор должен отдавать предпочтение не-разрушающим методам исследований. При необходимости пробу или навеску берут в самых минимальных количествах, не повредив предмет. Все анализы проводят до окончания реставрации предмета. Любое исследование должно подтверждаться соответствующей записью вреставрационном паспорте. На все исследования, про веденные в специальных учреждениях и лабораториях, выдается заключение с приложением негативов, фотографии, графиков, диаграмм, шифровок. Эти документы реставратор обязан приложить к реставрационному паспорту или научному отчету. зо
5. МЕТОДЫ ОЧИСТКИ, РЕСТАВРАЦИОННЫЕ МАТЕРИАЛЫ И ОБОРУДОВАНИЕ Очистку предмета от загрязнений и продуктов коррозии начинают только после проведения полного комплекса исследований, утвержденного реставрационным советом. Перед началом работы составляют программу реставрации и разрабатывают 'Методику по каждому пункту программы. От избранного метода зависит дальнейшая судьба памятника, 5.1. УДАЛЕНИЕ ЗАГРЯЗНЕНИЙ Жировые загрязнения. Все жировые загрязнения могут быть отнесены к двум основным группам: жиры минерального происхождения и жиры животного и растительного происхождения. Жиры минерального происхождения легко удаляются растворителями. Жиры животного и растительного происхождения легко омыливаются в водных растворах щелочей. Очистка органическими растворителями основана па их способности растворять минеральные масла и покрытия. Предметы очищают погружением в растворитель, протиранием тампоном или с помощью наложения компресса. Если предмет имеет высокохудожественную декоративную отделку: декор с втертой пас-топ, авторский красочный слой, искусственную патину или сочетание с органическими 'материалами, то очистку необходимо начинать с более щадящих растворителей. Растворители минеральных масел: 1. Спирты — этиловый, изоамиловый, бутиловый, метиловый, 2. Кетоны — ацетон, метилэтилкетон.
3. Ароматические углеводороды — толуол, ксилол. 4. Углеводороды — бензин, уайт-спирит. 5. Хлорированный углеводород — перхлорэтилен. 6. Сложные эфиры — метилацетат, амилацетат, этилацетат. 3!
Особую роль среди других компонентов очищающих раство. ров играют поверхностно-активные вещества (ПАВ). Они понижают поверхностное и межфазовое напряжение, улучшают смачивание поверхности; оказывают диспергирующее (расклинивающее) действие на твердые загрязнения, играют роль пенообразователей. Можно рекомендовать — алкилсульфонат, еульфонолы 11П-3, 11П-1, синтанол /1С-10, синтамид 5. Содержание ПАВ в растворах составляет 3—8 г/л.
Активным компонентом водных моющих составов является кальцинированная сода (карбонат натрия), которая поддерживает щелочность раствора и оказывает омыляющее действие на растительные и животные жиры. В процессе работы реставратор сам подбирает состав очиища-ющей смеси или раствора. Можно также использовать готовые моющие средства, выпускаемые промышленностью типа «Триа-лон-10», «Прогресс» и стиральные порошки «Ока» и «БИО-С» Для удаления старой краски можно применять фирменные растворители — 646, 648, Р-4, Р-5, которые состоят из смеси различных органических веществ. Старая краска удаляется с помощью компрессов, время выдержки определяется опытным путем. Этими средствами удаляются большинство старых лаков и смол. При очистке предметов средней загрязненности тампонным методом можно рекомендовать следующий состав: Полиакриламид 1% — 15 мл. Диталан ОПС — 55 мл. Ацетон — 15 мл. Этанол — 15 мл. Хорошо очищают комбинированные эмульсии: Вода — 1 ч. Керосин — 3 ч. Средство ОП-7 — 2% но весу. Для очистки от жировых и водорастворимых загрязнений можно использовать водный раствор ПАВ с углеводородами с добавлением маслорастворимого ингибитора коррозии: ПАВ — сульфанол — 20 г/л МСДА-II — ингибитор — 20 г/л Вода + растворитель — 5:1 или 1:2. Перед очисткой предмета _сначала делают пробную расчистку (зондаж), начиная с более слабого раствора и переходя к более сильному. Каждый растворитель имеет растворяющую способность, которую учитывают при составлении растворов. Хладон 113 — 4,45; трихлорэтан — 3,10; ксилол — 2.20; тетрахлорэти-лен — 1,7; бензин — 1,30; уайт-спирит — 0,90; керосин — 0,65. Составы для удаления труднорастворимых полимеров
То же | |||||||||||||||||||||||||||||||||||||||||||
| СП-6 |
| То же |
| Удаление мягких лаковых и непрочных олиф-ных пленок, масляной записи |
В реставрационной практике часто приходится встречаться с трудноудалимыми загрязнениями, покрытиями и клеевыми соединениями. Непрофессиональная реставрация, использование в полевых условиях недоброкачественных, первых попавшихся клеев и пропиточных материалов создает определенные трудности в работе. Ниже приводятся смеси растворителей для трудноудалимых полимеров и покрытий (масса в %):
| 1,3—Дпоксолан | ■ ■0 |
| Бензол | 30 |
| Этиловый спирт | 10 |
| Ацетон | 10 |
| 1,3—Диоксолан | 47,5 |
| Толуол | 28 |
| Ацетон | 19,0 |
| Коллоксилин | 5,0 |
| Парафин | 0,5 |
| Метиленхлорнд | 70,56 |
| Смола ПСХ-С | 11,24 |
| Диоксолан—1,3 | 9,21 |
| Ксилол | 5.62 |
| Уксусная кислота | 2,25 |
| Парафин | 1,12 |
| Метиленхлор.ид | 75,8 |
| Этиловый спирт | 8,4 |
| Аммиак 25% раствор | 6,2 |
| Метил целлюлоз а | 4 |
| Диэтиленгликоль | 2,5 |
| Эмульгатор ОП-7 | 1,5 |
| Жирные кислоты | |
| льняного масла | 1 |
| Парафин | 0,6 |
| Метиленхлорид | 85,5 |
| Этиловый спирт | 0 5 |
| Уксусная кислота | 0,9 |
| Эмульгатор ОП-7 | 1,7 |
| Ингибитор коррозии | ' 2,4 |
| Ацетон №ли | |
| мет.илэтилкетон | СО |
| Амилацетат | 25 |
| Пропиловый спирт | 25 |
32
33
| Pl-2 | Формальгликоль | 1-8 |
| Толуол | 27 | |
| Ацетон | 20 | |
| Этиловый спирт | 5 | |
| РТ.3 | ДИОКСЭ'Н | 25 |
| Ксилол | 20 | |
| Пропиловый спирт | 20 | |
| Ацетон | 15 | |
| Амилацетат | 10 | |
| Этиловый спирт | К) | |
| РТ-4 | ФормалылИ'.коль | 50 |
| Ацетон | 45 | |
| 1 | Этиловый спирт | 5 |
| РТ-5 | Ацетон | 45 |
| Формальгликоль | 20 | |
| Мзоамиловый спирт | 20 | |
| Уксусный анпидрид | 10 | |
| 1: f | Этиловый спирт | 5 |
| 646 | Толуол | 50 |
| Бутиловый спирт | 15 | |
| Этиловый спирт | 10 | |
| Бутилацетат | 10 | |
| Этилцеллозольв | 8 | |
| МП | Ацетон | 7 |
| 647 | Толуол | 41,3 |
| Бутилацетат | 29,8 | |
| Эт.илацетат | 21,2 | |
| Бутиловый спирт | 7,7 | |
| 648 | Бутилацетат | 50 |
| Бутиловый спирт | 20 | |
| Толуол | 20 | |
| Этиловый спирт | 10 | |
| 649 | Ксииол | 50 |
| Этилцеллозольв | 30 | |
| Изобутиловый спирт | 20 | |
| Р-4 | Толуол | 62 |
| Ацетон | 26 | |
| Бутнлацетат | 12 | |
| Р-40 | Толуол | 50 |
| Этилцеллозольв | 30 | |
| Аистон | 20 |
34
Активно действует на ли. нокси'новые пленки, старые темперные записи. При увеличение спирта и ацетона активность со. става повышается
Наличие-диоксана увеличивает токсичность
То же
Удаление лаковых пленок и темперных записей
Активно размягчает старые олифные пленки и др.
Удаление интратиеллю-лозных эпоксидных и кремннйорганических пленок
Удаление нитратцеллю-лозных покрытий
Удаление нитратцеллю-лозных пол.иакрилатиы.х, бутил метакрилатны.х, эпоксидных покрытий
Удаление нитратцеллю-
лозных и глифталевых
покрытий
Удаление полиакрилат-
пых и перхлорвинилом.^
покрытий
Удаление эпоксидных покрытии
Состав для очистки металла, фарфора, керамики на основе пленкообразующих полимеров — а-КМЦ, ПВС, ПВАД, ч. (масс):
Поливиниловый спирт 20—30 ПАВ (алкиглсульфонат 0,1—0,7
Этилендиамин 5 —10 натрия, алкилдиме-
Диметилсуфоксид 5 —10 тиламиноксид, синта-
Циклогексанон 5 —10 нол)
Вода 100
Глицерин 5
Загрязнения удаляются вместе с эластичной пленкой. Соотношение компонентов определяют при пробной очистке. Вязкую очищающую массу наносят на поверхность предмета слоем в 2— 4 мм и покрывают полиэтиленовой пленкой. Время выдержки от 30 мин до 2-х часов.
Растворители во время работы держат в стеклянных стаканчиках с притертыми пробками. Компрессы берут только пинцетами, т. к. некоторые соединения, входящие в состав растворителей, токсичны.
5.2, МЕХАНИЧЕСКАЯ ОЧИСТКА
Механическая очистка применяется на разных этапах реставрации предметов из металла. Она может 'быть основной и вспомогательной, т. е. чередоваться с другими методами очистки. Механическим методом удаляют рыхлые наслоения с поверхности предметов, пыль, остатки почвы, рыхлые продукты коррозии, краску, воск.
Обработку проводят как вручную, так и с применением различных механизмов. При ручной очистке используют скальпели различных видов, шаберы, иглы, стальные и латунные щетки, кисти из щетины, кисти из стекловолокна, абразивную резину, Деревянные палочки и т. д.
Часто для удаления наслоений применяют 'бормашину с различными насадками. Насадки предназначены для выполнения самого широкого диапазона работ. К >ним относятся боры стальные, боры алмазные, насадки абразивные различных профилей, стальные и латунные и щетиновые крацовки, диски корундовые и алмазные, шайбы резиновые, фетровые, хлопчатобумажные.
Крацеванием очищают поверхность от рыхлых продуктов коррозни с помощью вращающихся металлических щеток. Крацевание не удаляет достаточно плотных слоев коррозии, а в большеймере выравнивает и уплотняет поверхность предмета. Этот вид обработки очень удобен для выравнивании патины, цвета и фактуры предмета, а также для уплотнения гальванических покры-
35




 тий. Крацевание проводят при постоянном смачивание предмет и щетки мыльной водой или квасом.
тий. Крацевание проводят при постоянном смачивание предмет и щетки мыльной водой или квасом.
Пескоструйная очистка — метод абразивной очистки при, помощи сжатого воздуха. Сжатый воздух через гибкий шланг с наконечником подается в смеси с мелким песком, стеклом или гранулированным синтетическим материалом. Рыхлые наслоения под действием силы сжатого воздуха и действия микрочастиц твердого вещества удаляются. Интенсивность очистки регулируется давлением воздуха, количеством и размерами абразива. В реставрации используются специальные портативные установки зарубежного производства.
Очистка сжатым воздухом — очень мягкий метод очистки Регулируя давление и направление струи сжатого воздуха, возможно удалять пылевидные частицы и наслоения из углублений и отверстии, а также сушить предметы.
5.3. ЭЛЕКТРОЛИТИЧЕСКАЯ ОЧИСТКА
Метод является универсальным и пригоден для очистки металлов с хорошим и удовлетворительным ядром. Метод эффективен тем, что позволяет качественно н быстро очистить предмет от всех наслоений. Поэтому памятники истории, имеющие позолоту, инкрустации, лаковые покрытия, пасты, роспись и1 другие виды отделки, электролитическим методо
|
| Поделиться: |







 AgCl — хлорид серебра в, воде практически не растворим. Растворяется в растворах соответствующих солей щелочных металлов, аммиака, тиосульфатов.
AgCl — хлорид серебра в, воде практически не растворим. Растворяется в растворах соответствующих солей щелочных металлов, аммиака, тиосульфатов.






 3.б. коррозия Железа и его сплавоВ
3.б. коррозия Железа и его сплавоВ







 4.4. ФИЗИЧЕСКИЕ МЕТОДЫ АНАЛИЗА
4.4. ФИЗИЧЕСКИЕ МЕТОДЫ АНАЛИЗА







