ИЗ ИСТОРИИ МЕТАЛЛОВ
С незапамятных пор человечество познакомилось и использовало в своей деятельности основную «семерку» металлов: медь, золото, серебро, олово, ртуть, свинец, железо. История ремесел связана именно с этими металлами, которые не утратили своей значимости и до наших дней. В фол ее поздний период к ним добавились цинк, никель, алюминий и др. Поэтому до XVII ст. использовалось весьма ограниченное количество металла.
Человечество постепенно осваивало металл за металлом, изучая и используя их свойства. Каждый металл имеет свою биографию, которая окружена мифами, легендами и суеверными представлениями. Основное значение металлов состоит в том, что они сыграли решающую роль в развитии человеческого прогресса. Нож, топор, тесло, наконечники стрел и копий — первейшие орудия, изготовленные из самородного металла. На основании археологических находок можно предполагать, что человек познакомился с самородными металлами медью, золотом и серебром примерно десять тысяч лет назад.
Каждый металл имеет свои характерные признаки — цвет, твердость, ковкость, блеск. Древний мастер использовал эти свойства в зависимости от назначения изделия. Искал наиболее приемлемые способы обработки металла, полностью раскрывающие заложенные в нем декоративные возможности.
Кажется не было во все времена профессии более таинственной и почетной, чем кузнец. Древний кузнец был уподоблен чародею, магу, волшебнику. Его деятельность связывалась с колдовством, заклинаниями и божественными силами. Общение с огнем, плавка, ковка и литье металла поистине есть волшебство. Для современников кузнеца все эти процессы были непонятны и загадочны. Древний кузнец умел все, он был и художником и
8
исполнителем своих замыслов. Хороший мастер всегда ценился на вес золота, так как его руки рождали произведения искусства, которые можно сравнить лишь с песней, застывшей в металле.
СТРОЕНИЕ МЕТАЛЛОВ
Свойства металлов определяются их строением. Все вещества, в том числе и металлы, состоят из атомов. Каждый атом представляет собой очень сложную систему, состоящую из ядра и определенного количества вращающихся вокруг него отрицательно заряженных электронов. Ядро атома в свою очередь содержит протоны, имеющие положительный заряд, и нейтральные нейроны-
|
|
Все металлы и их сплавы в твердом состоянии имеют кристаллическое строение, то есть их атомы расположены в пространстве с геометрической правильностью. Кристаллизация металлов происходит при остывании расплавленного металла. Его затвердевание начинается с образования центров кристаллизации, где атомы располагаются в определенном порядке, образуя кристалл, имеющий правильную геометрическую фигуру в виде куба, призмы и т. д. В процессе кристаллизации кристаллы группируются в зерна, однако процесс этот проходит несвободно, углы их закругляются, сдавливаются, тем самым образуя зернистость сплава. Зернистость зависит от скорости охлаждения и состава сплава. Крупные зерна или, как иначе их называют, кристаллиты образуются при медленном охлаждении.
При ковке, прокате, тиснении кристаллы дробятся и сплющиваются, приобретая вытянутые формы. Если металл подвергнуть длительной ковке, то он станет жестким и легко разрушается. Такой металл называется нагартованным. Если нагартованный металл нагреть до определенной температуры, то структура его изменится, зерна примут прежнюю форму, но уже более равномерную по всем направлениям, и металл вновь приобретет пластичность- Такой процесс называется отжигом или рескристаллизацией.
КОРРОЗИЯ МЕДИ И ЕЕ СПЛАВОВ
Медь. Химический элемент, символ Си, имеет порядковый номер 29, атомный вес 63,54, основную валентность II, плотность 8.9 г/см3, температуру плавления 1083°С, твердость по Бринеллю 35 кгс/мм2. Медь имеет красный цвет, пластична, прекрасный проводник тепла и электрического тока, обладает высоким блеском.
Медь растворяется в серной кислоте в присутствии окислителей при концентрации раствора выше 60%. В присутствии воздуха Растворяется в соляной кислоте. Хорошо растворяется в азотной
17
|
|
 кислоте, а также реагирует с аммиаком и хлористым аммонием. Устойчива к щелочам. Химические свойства медных сплавов во многом сходны с медью.
кислоте, а также реагирует с аммиаком и хлористым аммонием. Устойчива к щелочам. Химические свойства медных сплавов во многом сходны с медью.
Процесс коррозии меди и ее сплавов в атмосферных условиях очень длительный и может продолжаться десятилетиями, Обычно образовавшиеся на поверхности медных сплавов сл0] носят защитный характер и препятствуют' дальнейшему разрушению металла. Такая коррозия называется «благородной патиной».
Цвет патины может иметь различные оттенки от коричневого до сине-зеленого, и зависит от ее состава. Например окись меди СuО — черного цвета; закись меди Сu2О — красно-коричневого. Зеленые, голубые и синие оттенки патине придают различные медные минералы — малахит, азурит, бромантит и многие другие. Практически компоненты патины нерастворимы в воде, негигроскопичны и нейтральны по отношению к металлу.
Археологические предметы из меди и медных сплавов имеют сложный состав и строение. Наружный слой состоит из углекислых солей меди, соединенных с почвой и органическими остатками, имеет бугристую неровную поверхность. В основном это малахит — СuСО3 • Сu (ОН)2 в смеси с азуритом — 2СuСО3 • Сu(ОН)2 синего цвета. Кроме углекислых солей во внешнем слое содержится хлорная медь атакамит CuCI2 X 3Cu (ОН)2. Следующие слой, лежащий на поверхности металла,— красно-коричневый куприт (закись меди) Cu2O. Куприт тверд и хрупок, имеет крупнокристаллическое строение. Куприт редко залегает сплошным слоем, чаще он имеет трещины и полости. Под слоем куприта, а иногда и заменяя его, располагается прослойка вторично высадившейся меди в результате электролитических процессов. Между слоем восстановленной меди и металлом или купритом и металлом расположена очень гигроскопичная и нестабильная хлористая медь CuCl светло-серого цвета. Хлористая медь—самая опасная соль, которая при взаимодействии с влагой окисляется и гидролизуется, превращаясь в основную хлорную медь, вовлекая в реакцию еще не разрушенную медь.
Для оловянистых бронз характерны локальные выделения двуокиси олова — касентерита SnО2. Для высокооловяниетых бронз с небольшим содержанием свинца отличительной особенностью является патина с глянцевым светло-серым цветом. Иногда оловянистые бронзы на сохранившихся полированных поверхностях имеют обманчивый цвет золочения.
Толщина коррозионного слоя медных, сплавов может колебаеться от долей миллиметра до полной минерализации. Большинство медных сплавов склонны к межкристаллитной коррозии. Внешне металл может выглядеть здоровым, однако прочность его
18
может быть потеряна из-за разрушения металла по границам зерен-
Химические свойства продуктов коррозии, меди и ее сплавов
Сu2О — закись меди (куприт) — не растворяется в холодной и горячей воде; плохо растворяется в щелочах и муравьиной кислоте; в холодной серной кислоте (разбавленной) разлагается с восстановлением меди; растворяется в горячих растворах серной кислоты и переходит в раствор в виде средних и кислых сернокислых солей; растворяется в аммиаке, углекислом аммонии и трилоне Б с образованием прочных комплексных соединений. Cuo — окись меди — в холодной и горячей воде не растворяется; не реагирует со щелочами; в щелочном растворе сегието-еой соли практически не растворяется; растворяется в кислотах.
|
|
CuCo3 • Cu(OH)2 — основная углекислая медь (малахит) — не растворяется в холодной воде, в горячей воде при кипячении разлагается с образованием окиси; при температуре 200°С разлагается на воду и окись меди; в щелочах частично растворяется, частично переходит в гидрат окиси; растворяется в кислотах, углекислом аммонии, аммиаке, сегнетовой соли.
CuCl — хлористая медь — гигроскопична,.неустойчива, в холодной воде не растворяется, при нагревании медленно гидролизуется, образуя гидрозакиси, которые затем разлагаются на - закись меди иводу; частично растворяется в серной кислоте, горячих растворах щелочей, медленно в муравьиной кислоте; растворяется в соляной кислоте, растворах углекислого аммония и аммиака.
ЗСu(ОН)2 • СиСl2 — основная хлорная медь (атакамит) — негиг-роскопична, нерастворима в холодной воде, при кипячении медленно разлагается с образованием черной закиси меди; частично растворяется в щелочах, частично переходит в синий гидрат окиси меди, затем в черную окись меди. SnO2 — двуокись олова — химически устойчива: переходит в раствор при длительном нагревании с концентрированной серной кислотой.
РbСОз — углекислый свинец — при температуре выше 300°С разлагается на Рb и СО2; плохо растворим в воде; растворяется в кислотах.
То же
| СП-6 |
| То же |
| Удаление мягких лаковых и непрочных олиф-ных пленок, масляной записи |
В реставрационной практике часто приходится встречаться с трудноудалимыми загрязнениями, покрытиями и клеевыми соединениями. Непрофессиональная реставрация, использование в полевых условиях недоброкачественных, первых попавшихся клеев и пропиточных материалов создает определенные трудности в работе. Ниже приводятся смеси растворителей для трудноудалимых полимеров и покрытий (масса в %):
| 1,3—Дпоксолан | ■ ■0 |
| Бензол | 30 |
| Этиловый спирт | 10 |
| Ацетон | 10 |
| 1,3—Диоксолан | 47,5 |
| Толуол | 28 |
| Ацетон | 19,0 |
| Коллоксилин | 5,0 |
| Парафин | 0,5 |
| Метиленхлорнд | 70,56 |
| Смола ПСХ-С | 11,24 |
| Диоксолан—1,3 | 9,21 |
| Ксилол | 5.62 |
| Уксусная кислота | 2,25 |
| Парафин | 1,12 |
| Метиленхлор.ид | 75,8 |
| Этиловый спирт | 8,4 |
| Аммиак 25% раствор | 6,2 |
| Метил целлюлоз а | 4 |
| Диэтиленгликоль | 2,5 |
| Эмульгатор ОП-7 | 1,5 |
| Жирные кислоты | |
| льняного масла | 1 |
| Парафин | 0,6 |
| Метиленхлорид | 85,5 |
| Этиловый спирт | 0 5 |
| Уксусная кислота | 0,9 |
| Эмульгатор ОП-7 | 1,7 |
| Ингибитор коррозии | ' 2,4 |
| Ацетон №ли | |
| мет.илэтилкетон | СО |
| Амилацетат | 25 |
| Пропиловый спирт | 25 |
|
|
32
33
| Pl-2 | Формальгликоль | 1-8 |
| Толуол | 27 | |
| Ацетон | 20 | |
| Этиловый спирт | 5 | |
| РТ.3 | ДИОКСЭ'Н | 25 |
| Ксилол | 20 | |
| Пропиловый спирт | 20 | |
| Ацетон | 15 | |
| Амилацетат | 10 | |
| Этиловый спирт | К) | |
| РТ-4 | ФормалылИ'.коль | 50 |
| Ацетон | 45 | |
| 1 | Этиловый спирт | 5 |
| РТ-5 | Ацетон | 45 |
| Формальгликоль | 20 | |
| Мзоамиловый спирт | 20 | |
| Уксусный анпидрид | 10 | |
| 1: f | Этиловый спирт | 5 |
| 646 | Толуол | 50 |
| Бутиловый спирт | 15 | |
| Этиловый спирт | 10 | |
| Бутилацетат | 10 | |
| Этилцеллозольв | 8 | |
| МП | Ацетон | 7 |
| 647 | Толуол | 41,3 |
| Бутилацетат | 29,8 | |
| Эт.илацетат | 21,2 | |
| Бутиловый спирт | 7,7 | |
| 648 | Бутилацетат | 50 |
| Бутиловый спирт | 20 | |
| Толуол | 20 | |
| Этиловый спирт | 10 | |
| 649 | Ксииол | 50 |
| Этилцеллозольв | 30 | |
| Изобутиловый спирт | 20 | |
| Р-4 | Толуол | 62 |
| Ацетон | 26 | |
| Бутнлацетат | 12 | |
| Р-40 | Толуол | 50 |
| Этилцеллозольв | 30 | |
| Аистон | 20 |
34
Активно действует на ли. нокси'новые пленки, старые темперные записи. При увеличение спирта и ацетона активность со. става повышается
Наличие-диоксана увеличивает токсичность
То же
Удаление лаковых пленок и темперных записей
Активно размягчает старые олифные пленки и др.
Удаление интратиеллю-лозных эпоксидных и кремннйорганических пленок
Удаление нитратцеллю-лозных покрытий
Удаление нитратцеллю-лозных пол.иакрилатиы.х, бутил метакрилатны.х, эпоксидных покрытий
Удаление нитратцеллю-
лозных и глифталевых
покрытий
Удаление полиакрилат-
пых и перхлорвинилом.^
покрытий
Удаление эпоксидных покрытии
Состав для очистки металла, фарфора, керамики на основе пленкообразующих полимеров — а-КМЦ, ПВС, ПВАД, ч. (масс):
Поливиниловый спирт 20—30 ПАВ (алкиглсульфонат 0,1—0,7
Этилендиамин 5 —10 натрия, алкилдиме-
Диметилсуфоксид 5 —10 тиламиноксид, синта-
Циклогексанон 5 —10 нол)
Вода 100
Глицерин 5
Загрязнения удаляются вместе с эластичной пленкой. Соотношение компонентов определяют при пробной очистке. Вязкую очищающую массу наносят на поверхность предмета слоем в 2— 4 мм и покрывают полиэтиленовой пленкой. Время выдержки от 30 мин до 2-х часов.
Растворители во время работы держат в стеклянных стаканчиках с притертыми пробками. Компрессы берут только пинцетами, т. к. некоторые соединения, входящие в состав растворителей, токсичны.
5.2, МЕХАНИЧЕСКАЯ ОЧИСТКА
Механическая очистка применяется на разных этапах реставрации предметов из металла. Она может 'быть основной и вспомогательной, т. е. чередоваться с другими методами очистки. Механическим методом удаляют рыхлые наслоения с поверхности предметов, пыль, остатки почвы, рыхлые продукты коррозии, краску, воск.
|
|
Обработку проводят как вручную, так и с применением различных механизмов. При ручной очистке используют скальпели различных видов, шаберы, иглы, стальные и латунные щетки, кисти из щетины, кисти из стекловолокна, абразивную резину, Деревянные палочки и т. д.
Часто для удаления наслоений применяют 'бормашину с различными насадками. Насадки предназначены для выполнения самого широкого диапазона работ. К >ним относятся боры стальные, боры алмазные, насадки абразивные различных профилей, стальные и латунные и щетиновые крацовки, диски корундовые и алмазные, шайбы резиновые, фетровые, хлопчатобумажные.
Крацеванием очищают поверхность от рыхлых продуктов коррозни с помощью вращающихся металлических щеток. Крацевание не удаляет достаточно плотных слоев коррозии, а в большеймере выравнивает и уплотняет поверхность предмета. Этот вид обработки очень удобен для выравнивании патины, цвета и фактуры предмета, а также для уплотнения гальванических покры-
35




 тий. Крацевание проводят при постоянном смачивание предмет и щетки мыльной водой или квасом.
тий. Крацевание проводят при постоянном смачивание предмет и щетки мыльной водой или квасом.
Пескоструйная очистка — метод абразивной очистки при, помощи сжатого воздуха. Сжатый воздух через гибкий шланг с наконечником подается в смеси с мелким песком, стеклом или гранулированным синтетическим материалом. Рыхлые наслоения под действием силы сжатого воздуха и действия микрочастиц твердого вещества удаляются. Интенсивность очистки регулируется давлением воздуха, количеством и размерами абразива. В реставрации используются специальные портативные установки зарубежного производства.
Очистка сжатым воздухом — очень мягкий метод очистки Регулируя давление и направление струи сжатого воздуха, возможно удалять пылевидные частицы и наслоения из углублений и отверстии, а также сушить предметы.
5.3. ЭЛЕКТРОЛИТИЧЕСКАЯ ОЧИСТКА
Метод является универсальным и пригоден для очистки металлов с хорошим и удовлетворительным ядром. Метод эффективен тем, что позволяет качественно н быстро очистить предмет от всех наслоений. Поэтому памятники истории, имеющие позолоту, инкрустации, лаковые покрытия, пасты, роспись и1 другие виды отделки, электролитическим методом очищать нельзя.
Для очистки электролитический,! методом необходимо иметь; емкость из стекла, химически стойкой органики или нержавеющей стали; источник постоянного тока до 10 А/дм2; медные или латунные штанги по размерам емкости; медный провод, пластину из нержавеющей стали; изоляционные прокладки и щелочь.
Подготовка и процесс очистки. Разводят щелочь — едкий натр, чаще всего используют 10% раствор и заливают в емкость Сверху устанавливают две штанги, па которые подвешивают предмет и нержавеющую пластину, используя медный провод. К предмету подключают от источника постоянного тока отрицательный полюс, к пластике — положительный. Далее предмет смачивают спиртом и при включенном источнике погружают в электролит.
При прохождении тока на катоде.идут восстановительные, реакции, при которых высшие окислы переходят в низшие, более растворимые. Кроме того, выделяющийся молекулярный водоро1 оказывает механическое воздействие, в результате которого происходит разрыхление и отслаивание продуктов коррозии.
Плотность тока зависит от сопротивления электролита, размеров предмета, размеров вспомогательного электрода, а также от электрического сопротивления продуктов коррозии. В процессе
очистки плотность тока увеличивается, поэтому ее необходимо постоянно регулировать, (рис. 3)..
Очень удобны ванны или емкости из токопроводящего материала — нержавеющей стали. В этом случае сама ванна служит анодом, поэтому штангу с предметом.необходимо изолировать от ванны. При обработке массовых мелких предметов их кладут в металлическую корзину, к которой подсоединят провод.
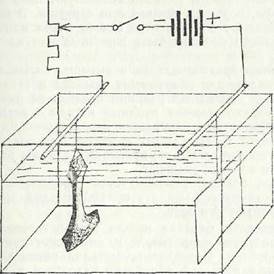
Pиc. 3. Г|рпнципиальная схема электролитической очистки металлических предметов.
По мере засорении электролита шламом его надо заменять
новым, а электроды или стенки металлической ванны очищать от
отложений. Предметы периодически необходимо извлекать из
электролита (при отключенном источнике тока) и очищать от
разрыхленных загрязнений.
5.4. ЭЛЕКТРОХИМИЧЕСКАЯ ОЧИСТКА
Электрохимическая очистка осуществляется при помощи катодного удаления продуктов коррозии без внешнего источника тока. Для этого составляется электрохимическая система из предмета, который необходимо очистить, металла, обладающего более положительным электрическим потенциалом, согласно ряду
36
37




 активности металлов а электролита. Процессы, происходящие в этом случае, не отличаются от процессов электролитической очистки.
активности металлов а электролита. Процессы, происходящие в этом случае, не отличаются от процессов электролитической очистки.
Электрохимическая обработка является более «мягким» способом очистки. Ее можно использовать для очистки археологичес кого металла даже в случае, если металлическое ядро заменено купритом. По сравнению с электролитической такая очистка идет значительно медленней, но равномернее по всей поверхности.
В качестве анодного металла используют цинк или алюминий в виде гранул, порошка, фольги.или стружки. В качестве электролита используют 5% раствор едкого натра или 10% серную кислоту. Емкости должны быть железные или из термостойкого стекла.
Для очистки предмет кладут в емкость, засыпают гранулированным металлом или обертывают фольгой и заливают электролитом. Если за один цикл реакции предмет не очистится, то обработку повторяют, сменив анодный металл и электролит. Цинк в процессе обработки покрывается нерастворимыми гидроокислами, что приводит к замедлению процесса. Для повторного использования его промывают и обрабатывают слабым раствором соляной кислоты и вновь промывают.
В процессе очистки рекомендуется периодически осматривать предмет и механически удалять щеткой рыхлые продукты с последующей промывкой в воде.
На поверхности металла нельзя оставлять следы непреобразованных продуктов коррозии, т. к. о>ни могут явиться причиной активной коррозии. Поверхность металла после электролитической и электрохимической обработки находится в ярко выраженном активном состоянии, поэтому после прекращения работы предмет необходимо тщательно промыть.
5.5. ПРОМЫВКА
Промывка в воде является одним да методов очистки, т. к. водой удаляются растворимые в цен вещества. После удаления продуктов коррозии поверхность металла представляет собой микроскопически пористую поверхность, которая удерживает остатки реактивов и коррозионных активаторов.
Предметы промывают в проточной воде.и нейтрализуют остатки кислот 1 % раствором щелочи 'или соды; остатки щелочен 1 % раствором кислоты обычно борной и вновь промывают ил Я кипятят в дистиллированной воде. Если же такая промывка не дает стопроцентного результата, тогда применяется так называе' мый метод глубокой 'промывки. Предмет длительное время выдерживается в дистиллированной воде при чередовании нагрев11 и охлаждения. При нагреве жидкость шп воздух в капилляра
о1шфяется и частично удаляется, а при охлаждении в капал- ' рУ поступает чистая вода. Применяя многократное чередова-иие,нагрева и охлаждения с периодической заменой воды, можно добиться практически1 удаления всех растворимых солен и хлористых соединении. Этот метод применим для всех металлов за исключением свинца, так как горячая вода образует на поверхности свинца молочно-белую пленку гидроокиси.
Качество промывки определяют измерением рН среды. Для проверки к предмету прикладывают индикаторную бумагу и по изменению цвета определяют качество промывки. При нейтральной среде цвет индикаторной бумаги не меняется.
Для проверки воды на присутствие хлоридов в пробирку отбирают 10 мл промывочной воды, добавляют в нее несколько капель азотной кислоты и несколько капель азотнокислого серебра (1% раствор). Через несколько минут, при наличии в воде хлоридов, вода помутнеет вследствие образования нерастворимого хлорида серебра,
5.6. ХИМИЧЕСКАЯ ОЧИСТКА
Существует много рецептов для химической очистки металлов. Одни из них универсальны, другие предназначены для конкретных металлов с определенной степенью сохранности. В работе нет необходимости использовать все рецепты, реставратор сам, опираясь на результаты исследований и знание химических законов, находит правильное решение.
Химическая очистка металлов от продуктов коррозии — это реакции взаимодействия между окислами, солями, кислотами, ще-ЛОчам.и, газами и т. д. Она проще остальных видов обработки, на нее тратится меньше времени, после удаления продуктов коррозии металл стабильнее, его легче хранить.
Применяя химический метод, необходимо ясно представлять процессы, происходящие между продуктами коррозии, металлом 11 применяемым для очистки реактивом. Существует ряд правил, которые необходимо помнить и строго соблюдать.
Общ-им условием при химической очистке является постоянный контроль за процессом удаления продуктов коррозии. Пред-Мет нельзя оставлять в растворе па длительное время, его необходимо периодически вынимать, осматривать п промывать про-очной подои. Периодически также удаляют с предмета разрыхленные п трудпораствор-нмыс продукты. Необходимо следить за Тем, чтобы реакция по всей поверхности протекала равномерно, Для этого как можно чаще проводят промежуточную м'ехан-ичее-■ую очистку. Предмет всегда должен быть полностью погружен- м в раствор, иначе по ватерлинии произойдет растравливание


 металла. Необходимо пошить, что повышение температуры рам вора ускоряет процесс очистки, а перемешивание создает уело." вия для равномерного очищения поверхности металла.
металла. Необходимо пошить, что повышение температуры рам вора ускоряет процесс очистки, а перемешивание создает уело." вия для равномерного очищения поверхности металла.
Все реактивы, применяемые в реставрации, не должны оказывать разрушающее действие на металлы и другие материалы Применяемые растворы должны иметь допустимый уровень концентрации, предпочтение всегда должно отдаваться наиболее щадящим реактивам, даже есл'И это связано с длительной затратой времени.
Бее растворы для очистки вырабатываются, насыщаются растворенными солями, поэтому они не должны.использоваться длительное время. Например, по мере накопления продуктов коррозии в растворе при очистке меди и ее сплавов (синий раствор), из них на поверхность предмета начинает осаждаться медь,.которую затем очень трудно удалить. Кроме того, в отработанных растворах, имеющих большое количество медных солей, меняется кислотность раствора, что приводит к растравливанию металла.
Химическая очистка не требует сложного оборудования. Важно, чтобы используемая посуда и емкости были устойчивы к действию кислот, щелочен, солей и растворителей. Для нагревания растворов необходимо иметь стеклянную термостойкую посуду и химически стойкие металлические емкости. Для извлечения и погружения предметов в растворы применяют всевозможные металлические и пластмассовые пинцеты, зажимы или индивидуально.изготовленные простые приспособления. Важно, чтобы инструмент не вступал в реакцию с раствором, т. к. возможно образование новых сшей и осаждение чистого металла на реставрируемом предмете- Лучше всего, если инструменты будут нейтральны 'К раствору или изготовлены из того же металла, что и предмет.
Для химической очистки меди и ее сплавов лучше использовать органические кислоты типа яблочной, лимонной — 10—20% растворы. Хорошо очищают поверхность 30% раствор муравьиной кислоты; 5—10% раствор уксусной кислоты; 10—15% раствор аммиака и карбоната аммония растворяют оке и дно-солевые наслоения. Высокой очищающей способностью обладают растворы трилона Б {динатриевая соль этилендияминтетрауксусной кислоты), удаляющие оксидно-солевые и карбонатно-кальциевыс наслоения. Процесс очистки происходит медленно, но его необходимо контролировать для предотвращения растворения металла.
Известковые наслоения удаляются с помощью гексаметафос-фата натрия 20% раствором при температуре 40—50°С. Бронзу с позолотой можно очищать сегнетовой солью (тартрат калия-натрия).
40
Серебро, покрытое окислами, сульфидами и хлоридами, мож-
очистить в насыщенном растворе тиосульфата натрия, в 10%
йаСТ.воре трилона Б. В очищающие составы для серебра вводят
Еяамочевину, ортофосфорную кислоту, соляную кислоту, ПАВ,
эмульгаторы, мел, полимеры.
Подробно метод химической очистки основных металлов будет рассмотрен ниже в отдельной главе,
5.7. ЗАЩИТА МЕТАЛЛОВ ПРИ ОЧИСТКЕ
Для защиты металлов от появления новой коррозии при промывке, в процессе обработки в различных растворах при очистке, а также при хранении используют ингибиторы.
Защита металлов ингибиторами коррозии основана па свойстве некоторых химических соединений при введении их в коррозионную среду замедлить скорость коррозионного процесса или полностью его подавлять, В зависимости от способа действия ингибиторы бывают пленкообразующие (пассиваторы) и адсорбирующиеся (включая и летучие ингибиторы).
Пассиваторы — все вещества, которые образуют с ионами металлов нерастворимые продукты и формируют пленку до 0,01 мкм. К ним относятся фосфаты, силикаты, бензоаты щелочных металлов, нитраты, хроматы, пертехнаты и т. д.
Адсорбирующиеся ингибиторы — органические ингибиторы характеризуются тем, что, попав на поверхность металла, адсорбируются ею и замедляют скорость ионизации металла и кислорода. К ним относятся слабые органические азотсодержащие основания, органические производные гидроксиламина, натриевые соли низкомолекулярных органических '.кислот,и т. д.
Различают ингибиторы для цветных металлов и черных металлов, а также ингибиторы, способные одновременно защищать черные и цветные металлы.
Разрушение поверхности уже очищенного металла может происходить при промывке водой. Особенно подвержены коррозии черные металлы. Скорость коррозии сильно зависит от жесткости воды, мягкая вода отличается повышенной коррозиен по сравнению с жесткой. Замедление окисления при промывке способствует связыванию растворенного в воде кислорода восстановителем, например, гидрозином. Концентрация ингибитора 1 г/л.
В 'кислых растворах при очистке чаще всего применяют органические ингибиторы. Например, в растворе при обнажении по-^рхно-сти железа оно становится анодом, а окислы —- катодом. Поэтому большая часть раствора кислоты расходуется на раст-Равлийание обнаженного металла. Применение.ингибитора позволяет предупредить разрушение металла.
41
 | |||||||||||
 | |||||||||||
 | |||||||||||
 | |||||||||||
 | |||||||||||
 | |||||||||||
 | |||||||||||
|
6. УДАЛЕНИЕ И
СТАБИЛИЗАЦИЯ
ПРОДУКТОВ КОРРОЗИИ
ЭЛЕКТРОХИМИЧЕСКИЙ
И ЭЛЕКТРОЛИТИЧЕСКИЙ СПОСОБЫ
Состав сплавов,
Имитирующих серебро
Массовая
доля компонентов, %
Ой
Продолжение
| Содержание компонентов, % | пература ijia плавде- ,°с | пература ного pacts ления, °С | | цел прочно-при растяни, МПа | ||||||||||
| Марка Щ) НПОЯ | Sn | Pb | Sb | Cd | Zn | Bf | Гп | Ga | с Ьа | ||||
| Сплав В уда Сплав Розе | 78-80 37,5—39,5 32,3—34,3 12- 13 24,5—25,5 50 75 | 32,4—34,4 24 - 25 24,5—25,5 15 | : 1 | О л о в ( 19—21 56,7—58,7 ВИ( 12-13 И | > - к а д mi 0,9—1,1 м у т о в i д и е в ы 5 | г е в ы е п !,8—2,8 ые п р и е при | р и п о и ПОИ 33,3—33,4 19-51 49-51 п о и | 80 50 25 | __ | s ^ ж Н х = 170 150 120, 66 90 117 | ? Ч те «Ос; — ее 175 165 130 70 92 156,4!20 231 | Ь в 5 55 65 60 61 70 . | О >* 35—40 40—47 |
| 3! — О ^ JC От i.' — О -1 -• Oi О =■ !О 1 1 jjj — ic — n^ to oo ^_i к:- ел — Сдэ ю to jvi м со to (p С*1 | О о fo: О а и Й я |
| — ~ — | , , | , с^ cj ю — . . г г ■.; ■ • У | |
| й. «5 J |- | j | I | | -I-- | 1 11! 2 | |
| 1 1 1 О сп | 1 ■ 1 | | | | | [ | со j | | $ | |
| 11[1|- «*" М |11111|1 ««=-^|. ^ | |
| а £ 1 - со | 1 | |- 1 I | " | | | 1 | | " IS " 1 | н | -S ^ 1 1 1 ! 1 1 1 1 1 1 1 i I I I f i 1 й | |
| ел сп сп а-, - л д -. oi --1 ее -j en ~-i -j -1 -j -1 --д 1 емпература SSoioBBioocn^BooS^ % "Z начала плав-" ления, С | |
| Температура полного расплавления, °С 860 775 700 779 850 775 725 775 850 795 '. 710 810 755 700 650 800 605 | |
| прочности при растяж* ник, МПа. 300-350. 300- 350 370 - 500 28Р 380—440 | Предел |
 | |||||||||
 | |||||||||
 | |||||||||
 | |||||||||
 | |||||||||
Продолжение Температура пайки, |
Состав и свойства флюсов






