
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Образуются металлами (MgO;CrO;CuO и дp)Содержание книги
Поиск на нашем сайте
Al203, BeO, ZnO, PbO, Cr203, SnO, SnO Образуются неметаллами и Металлами в высших Степенях окисления (СO2; Р Сновные Амфотерные Кислотные
Основными оксидами называются такие, которые при взаимодействии с кислотами образуют соль и воду. Соединения этих оксидов с водой относят к классу оснований (например, оксиду Na20 соответствует основание NaOH). Кислотными оксидами называются такие, которые при взаимодействии с основаниями образуют соль и воду. Соединения этих оксидов с водой относят к классу кислот (например, оксиду Р2O5 соответствует кислота Н3РO4, а оксиду С1207 - кислота НСlO4). К амфотерным оксидам относятся такие, которые взаимодействуют с кислотами и основаниями с образованием соли и воды. Соединения этих оксидов с водой могут иметь как кислотные, так и основные свойства (например, амфотерному оксиду ZnO соответствует основание Zn(OH)2 и кислота H2ZnO2).
Основания – это сложные вещества, молекулы которых состоят из атома металла и одной или нескольких гидроксильных групп – «ОН» Формула оснований: Ме(ОН)х х – число гидроксильных групп, равное валентности металла. Примеры оснований: NaOH, Ba(OH)2, Fe(OH)3 и т.д. Кислоты – это сложные вещества, содержащие атомы водорода, которые могут замещаться атомами металла. Общая формула кислот: Нх(Ас) х – число атомов водорода, равное валентности кислотного остатка, Ас – кислотный остаток. Примеры кислот: НСl, H2 SO4, H3 PO4 и т.д. Соли – это сложные вещества, состоящие из атомов металла и кислотных остатков. Формула солей: Мех (Ас)у Примеры солей: NaCl, BaSO4, Mg(NO3)2 и т.д.
Упражение
1. Классифицируйте следующие сложные неорганические соединения: КСl, Zn(OH)2, CaO, P2O5, HMnO4, KOH, Cu(OH)2, Fe(NO3)2, Al2(SO4)3, MgCO3, NO, SO2, BaSO4, HCl, H3PO4 Формулы веществ выписываем в таблицу: HMnO4, HCl, H3PO4
Zn(OH)2, KOH, Cu(OH)2 КСl, Fe(NO3)2, Al2(SO4)3, MgCO3 BaSO4
2. Составьте формулы 5 оксидов, 5 оснований, 5 солей и 5 кислот. Оксиды: F2O, NO, P2O5, CO, B2O3 Кислоты: H2SO4, HClO, HClO2, H2CO3, HF Основания: Ba(OH)2, Fe(OH)3, LiOH, NaOH, Zn(OH)2 Соли: LiNO3, ZnSO4, AlPO4, BaCO3, Mg(NO3)2
Кислотные дожди. Показатель кислотности растворов рН.
Кислотные осадки представляют собой различные виды атмосферных осадков (дождь, снег, туман, роса) с кислотностью выше нормы.
Понятие кислотности
Кислотность водного раствора определяется присутствием в нем положительных водородных ионов Н+ и характеризуется концентрацией этих ионов в одном литре раствора C(H+) (моль/л или г/л). Щелочность водного раствора определяется присутствием гидроксильных ионов ОН– и характеризуется их концентрацией C(ОН–). Как показывают расчеты, для водных растворов произведение молярных концентраций водородных и гидроксильных ионов – величина постоянная, равная C[H+]·C[ОН–] = 10–14, другими словами, кислотность и щелочность взаимосвязаны: увеличение кислотности приводит к снижению щелочности, и наоборот. Раствор является нейтральным, если концентрации водородных и гидроксильных ионов одинаковы и равны (каждая) 10–7 моль/л. Такое состояние характерно для химически чистой воды. Из сказанного следует, что для кислых сред выполняется условие: 10–7 < C [H+], для щелочных сред: C[H+] < 10–7.
На практике степень кислотности (или щелочности) раствора выражается более удобным водородным показателем рН, представляющим собой отрицательный десятичный логарифм молярной концентрации водородных ионов: рН = –lgC[H+] Например, если в растворе концентрация водородных ионов равна 10–5 моль/л, то показатель кислотности этого раствора рН = 5. В кислых растворах рН < 7, и чем меньше, тем кислее раствор. В щелочных растворах рН > 7, и чем больше, тем выше щелочность раствора.
Шкала кислотности идет от рН = 0 (крайне высокая кислотность) через рН = 7 (нейтральная среда) до рН = 14 (крайне высокая щелочность). Показатель кислотности рН различных веществ, встречающихся в повседневной жизни, приведен на рис. 1.
Чистая природная, в частности дождевая, вода в отсутствие загрязнителей тем не менее имеет слабокислую реакцию (рН = 5,6), поскольку в ней легко растворяется углекислый газ с образованием слабой угольной кислоты: СО2 + Н2О → Н2СО3. Для определения показателя кислотности используют различные рН-метры, в частности дорогостоящие электронные приборы. Простым способом определения характера среды является применение индикаторов – химических веществ, окраска которых изменяется в зависимости от рН среды. Наиболее распространенные индикаторы – фенолфталеин, метилоранж, лакмус, а также естественные красители из красной капусты и черной смородины.
|
||||||
|
Последнее изменение этой страницы: 2021-05-12; просмотров: 109; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.144.255.110 (0.007 с.) |

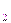 , GeO, GeO2, Sb
, GeO, GeO2, Sb  O
O  , MnO2 и др.
, MnO2 и др. O
O  ; Мn2O7 и др.)
; Мn2O7 и др.)


