
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Сернистый газ и серный ангидрид, свойства
1. Оксид серы (IV) имеет формулу SO2. SO2 – сернистый газ, без цвета, имеет резкий запах, плохо растворим в воде. Является типичным кислотным оксидом. При растворении в воде взаимодействует с ней, образуя слабую сернистую кислоту, которая способна обратно разлагаться на воду и сернистый газ:
Как кислотный оксид, способен реагировать с основными и амфотерными оксидами: SO2 + Na2O = Na2SO3 SO2 + ZnO = ZnSO3 Сернистый газ хорошо реагирует со щелочами: SO2 + 2KOH = K2SO3 + H2O
При недостатке щёлочи возможно образование кислых солей (гидросульфитов): SO2 + KOH = KНSO3
Так как в SO2 сера S находится в промежуточной степени окисления +4, то сернистый газ может проявлять как окислительные, так и восстановительные свойства. Сернистый газ как восстановитель способен окисляться до более высшего оксида серы: +4 -2 0 +6 -2 2SO2 + O2 = 2SO3 Как окислитель, SO2 способен реагировать с такими сильными восстановителями, как сероводород H2S: +4 -2 +1 -2 0 +1 -2 SO2 + 2H2S = 3S + 2H2O Получают сернистый газ в промышленности окисление сульфидов и серы: +2 -2 0 +2 -2 +4 -2 2ZnS + 3O2 = 2ZnO + 2SO2 0 0 +4 -2 S + O2 = SO2
В лаборатории сернистый газ можно получить действием на сульфиты растворами сильных кислот:
Na2SO3 + 2HCl = 2NaCl + H2O + SO2↑
2. Оксид серы (VI) – SO3 Оксид серы (VI) также еще называют серным ангидридом. При обычных условиях SO3 – легколетучая бесцветная жидкость с неприятным запахом. Серный ангидрид SO3 является сильным кислотным оксидом. SO3 хорошо растворяется в воде с образованием серной кислоты: SO3 + H2O = H2SO4 Как кислотный оксид, реагирует с основными и амфотерными оксидами: SrO + SO3 = SrSO4 BeO + SO3 = BeSO4 Серный ангидрид хорошо реагирует с основаниями: SO3 + 2LiOH = Li2SO4 + H2O
При недостатке щелочи возможно образование кислых солей (гидросульфатов): SO3 + LiOH = LiНSO4
В молекуле SO3 сера S находится в максимальной степени окисления +6, поэтому может проявлять только окислительные свойства и понижать степень окисления: +6 -2 +1 -2 +4 -2 +1 -2 3SO3 + H2S = 4SO2 + H2O
Получают SO3 в промышленности окислением SO2 при использовании катализаторов:
+4 -2 0 V2O5 +6 -2 2SO2 + O2 = 2SO3 Также SO3 можно получать при прокаливании сульфатов: t SnSO4 = SnO + SO3
Сероводород. Сероводородная кислота образуется при растворении в воде сероводорода H2S. Сероводород H2S – газ при обычных условиях с характерным запахом тухлых яиц, токсичен, плохо растворим в воде. Получение H2S. 1) Из простых веществ 0 0 t +1 -2 H2 + S = H2S 2) Взаимодействие сульфидов с сильными кислотами ZnS + H2SO4 = ZnSO4 + H2S↑
Химические свойства H 2 S. 1) Диссоциация H2S является слабой кислотой, поэтому плохо распадется на ионы и считается слабым электролитом.
2) Взаимодействие с основными оксидами H2S + CaO = CaS + H2O
3) Взаимодействие с основными гидроксидами H2S + 2NaOH = Na2S + 2H2O С амфотерными оксидами и гидроксидами сероводородная кислота реагирует плохо, так как все амфотерные оксиды и гидроксиды не растворимы, хорошо растворяются только в сильных кислотах, а H2S является слабой кислотой. 4) Взаимодействие с металлами 0 +1 -2 +2 -2 +1 -2 Ca + H2S = CaS + H2O
5) Взаимодействие с солями H2S + Pb(CH3COO)2 = PbS↓ + 2CH3COOH
6) Взаимодействие с окислителями Сера S в сероводородной кислоте H2S находится в минимальной степени окисления –2, поэтому H2S может проявлять только восстановительные свойства. H2S является сильным восстановителем, поэтому активно реагирует с окислителями. +1 -2 +1 +6 -2 +4 -2 +1 -2 H2S + 3H2SO4 = 4SO2 + 4H2O +1 -2 +2 -2 0 0 +1 -2 H2S + CuO = Cu + S + H2O
7) Восстановительные свойства сульфидов Сульфиды – соли сероводородной кислоты, также являются сильными восстановителями. +1 -2 +1 +7 -2 +1 -2 +1 +1 +6 -2 0 +1 -2 +1 Na2S + 2KMnO4 + 2KOH = 2K2MnO4 + S + 2NaOH
+1 -2 +1 -1 0 +1 -2 +1 K2S + H2O2 = S + 2KOH
|
||||||
|
Последнее изменение этой страницы: 2021-05-27; просмотров: 51; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.143.4.181 (0.012 с.) |

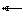 SO2 + H2O H2SO3
SO2 + H2O H2SO3
 H2S 2H+ + S2-
H2S 2H+ + S2-


