
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Химические свойства кислотных оксидов
1) Взаимодействие с водой Все кислотные оксиды взаимодействуют с водой с образованием кислот, кроме оксида кремния SiO2 (он не растворяется в воде, и соответствующая ему кремниевая кислота H2SiO3 также в воде не растворима). P2O5 + 3H2O = 2H3PO4 SO3 + H2O = H2SO4
2) Взаимодействие с основными оксидами
N2O5 + Na2O = 2NaNO3 CO2 + CaO = CaCO3
3) Взаимодействие с амфотерными оксидами SO3 + ZnO = ZnSO4 Al2O3 + 3Cl2O7 = 2Al(ClO4)3
4) Взаимодействие с основными гидроксидами CO2 + 2KOH = K2CO3 + H2O
5) Взаимодействие с амфотерными гидроксидами 3SO3 + 2Fe(OH)3 = Fe2(SO4)3 + 3H2O
6) Взаимодействие с солями
t CaCO3 + SiO2 = CaSiO3 + CO2↑ В данной реакции твердый оксид кремния SiO2 вытесняет из соли углекислый газ CO2. t Ca3(PO4)2 + 3SiO2 = 3CaSiO3 + P2O5
В данной реакции твердый оксид кремния SiO2 вытесняет из соли также твердый оксид фосфора P2O5, так как является менее летучим (то есть имеющим более высокие температуры плавления и кипения в отличие от оксида фосфора P2O5).
С чем могут реагировать основные и амфотерные гидроксиды. Как определить тип гидроксида. 1. Гидроксиды делятся на 2 типа: 1) Основные гидроксиды (основания) – это гидроксиды, образованные типичными металлами, а также переходными металлами в низших степенях окисления. К ним относятся NaOH, Ca(OH)2, Fe(OH)2, Cu(OH)2, Mg(OH)2, Cr(OH)2, Mn(OH)2. 2) Амфотерные гидроксиды – это гидроксиды, образованные переходными металлами в единственных или промежуточных степенях окисления. К ним относятся Zn(OH)2, Al(OH)3, Fe(OH)3, Cr(OH)3. Химические свойства основных гидроксидов 1) Взаимодействие с кислотными оксидами 2NaOH + SO2 = Na2SO3 + H2O Fe(OH)2 + N2O5 = Fe(NO3)2 + H2O 2) Взаимодействие с амфотерными оксидами и гидроксидами Когда вещества находятся в растворенном состоянии (в растворе), то образуется комплексная соль при обычных условиях: NaOH(р-р) + Al(OH)3 (р-р) = Na[Al(OH)4] 3NaOH(р-р) + Al(OH)3 (р-р) = Na3[Al(OH)6] 3) Взаимодействие с кислотами Cr(OH)2 + H2SO4 = CrSO4 + 2H2O LiOH + HCl = LiCl + H2O
4) Взаимодействие с растворимыми солями, с образованием нерастворимых гидроксидов
CuCl2 + 2KOH = Cu(OH)2↓ + 2KCl
Данная реакция является обменной, поэтому в ходе реакции должно выполняться одно из условий протекания ионного обмена. В данном случае здесь возможно образование только нерастворимого гидроксида.
5) Разложение нерастворимых оснований t Mg(OH)2 = MgO + H2O
Химические свойства амфотерных гидроксидов 1) Взаимодействие с кислотными оксидами Zn(OH)2 + SO3 = ZnSO4 + H2O
2) Взаимодействие с основными оксидами и гидроксидами 3) 2NaOH(р-р) + Zn(OH)2 (р-р) = Na2[Zn(OH)4]
4) Взаимодействие с кислотами Cr(OH)3 + 3HBr = CrBr3 + 3H2O
5) Разложение при прокаливании (нагревании) Все амфотерные гидроксиды не растворяются в воде, поэтому при прокаливании будут разлагаться на амфотерный оксид и воду. t 2Cr(OH)3 = Cr2O3 + 3H2O
С чем могут реагировать кислоты Химические свойства кислот 1) Взаимодействие с металлами
+1 +6 -2 0 +2 +6 -2 0 H2SO4 + Sn = SnSO4 + H2↑ +1 -1 0 +2 -1 0 2HCl + Zn = ZnCl2 + H2↑
2) Взаимодействие с основными и амфотерными оксидами 2HI + MnO = MnI2 + H2O H2SO4 + Na2O = Na2SO4 + H2O 2HNO3 + ZnO = Zn(NO3)2 + H2O 6HCl + Al2O3 = 2AlCl3 + 3H2O
3) Взаимодействие с основными и амфотерными гидроксидами 2H3PO4 + 3Ca(OH)2 = Ca3(PO4)2↓ + 6H2O HCl + KOH = KCl + H2O H2SO4 + Zn(OH)2 = ZnSO4 + 2H2O 3HBr + Cr(OH)3 = CrBr3 + 3H2O
4) Взаимодействие с солями
СО2↑ Н2О
HCl + AgNO3 = AgCl↓ + HNO3
В последней реакции нарушается правило о том, что более сильная кислота вытесняет более слабую, но при этом выполняется условие протекания обменных реакций – выпадение осадка, нерастворимого в кислотах, поэтому реакция идет.
5) Разложение некоторых слабых кислот при нагревании При нагревании способны разлагаться такие слабые кислоты, как H2SiO3, H2CO3, H2SO3 t H2SiO3 = SiO2↓ + H2O t H2SO3 = SO2↑ + H2O
10. С чем могут реагировать металлы
|
||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-05-27; просмотров: 50; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.133.111.85 (0.013 с.) |
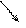
 2HCl + CaCO3 = CaCl2 + H2CO3
2HCl + CaCO3 = CaCl2 + H2CO3


