
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Ряд дополнительных вопросов.Стр 1 из 10Следующая ⇒
Ряд дополнительных вопросов. 69. 70. Какими металлами является Be и Mg 71. Взаимодействие перманганата калия и оксида марганца (4) с соляной кислотой. 72. Взаимодействие железной окалины с соляной кислотой и конц серной кислотой. Ответы. 1. В периодах слева направо уменьшается радиус атома, нарастают окислительные и неметаллические свойства и электроотрицательность, соответственно, уменьшаются восстановительные и металлические свойства. В группах сверху вниз нарастают восстановительные и металлические свойства, увеличивается радиус атома, соответственно, уменьшаются окислительные и неметаллические свойства и электроотрицательность
2. По номеру периода можно определить число энергетических уровней в элементе, по номеру группы – его высшую валентность и число электронов на внешнем уровне, также максимальную положительную степень окисления. Например, азот N, находится в пятой группе, его максимальная валентность V, число внешних электронов 5, если он отдаст все пять электронов с внешнего уровня, его максимальная степень окисления будет равна +5, также ему не хватает до завершения внешнего уровня взять 3 электрона, тогда его степень окисления будет равна -3, или отдать 5 электронов, тогда степень окисления будет +5
3. Окислитель – тот кто берет электроны, Восстановитель – тот кто отдает электроны. Окислитель берет электроны и восстанавливается тем самым (восстановление процесс принятия электронов). Восстановитель отдает электроны тем самым он окисляется (окисление процесс отдачи электрона) Легче запомнить кто такой окислитель и восстановитель а процессы характерные им имеют противоположные названия. Окислители берут электроны и степень окисления их понижается засчет отрицательного заряда электронов, а восстановители отдают электроны и повышают свою степень окисления, так как они отдают минусы
Металлы – только восстановители, и имеют поэтому только положительные степени окисления, а неметаллы могут быть и окислителями и восстановителями, поэтому могут иметь как положительные та и отрицательные степени окисления, кроме фтора, так как фтор – только окислитель, и он самый сильный окислитель.
4. Виды химических связей:
Ковалентная связь Ионная связь Металлическая связь Водородная связь Ковалентная связь возникает при образовании общих электронных пар. Ковалентная связь возникает только у неметаллов и бывает 3-х видов: ковалентная неполярная, ковалентная полярная и ковалентная связь с донорно-акцепторным механизмом. Ковалентная неполярная связь образуется между атомами неметаллов с одинаковой электроотрицательностью (Э.О.), то есть между атомами одного химического элемента Cl2 H2 P N2 Ковалентная полярная связь возникает между атомами неметаллов с разной электроотрицательностью. HCl H2O BF3 Донорно-акцепторная связь присутствует в ионе аммония NH4+ Ионная связь образуется между атомами металла и неметалла. Данный вид связи характерен для всех оксидов металлов (ZnO, Na2O, Fe2O3, CaO), для всех солей, так как там присутствуют связи «металл – неметалл» (CaCl2, NaF, CuSO4, Ag3PO4). Металлическая связь характерна для всех простых металлов (K, Ba, Mn, Pb и т.д.) Водородная связь в большинстве случаев образуется между молекулами, то есть, преимущественно, является межмолекулярной связью. Водородная связь – это связь, образующаяся между атомом водорода H одной молекулы и сильно электроотрицательным элементом другой молекулы. Водородная связь образуется между молекулами галогенводородов (HCl, HBr, HI), воды H2O, спиртов, минеральных и органических (карбоновых) кислот. По виду частиц, которые существуют в веществе, кристаллическую решётку разделяют на 4 типа: Атомная кристаллическая решётка Основные оксиды. Химические свойства кислот 1) Взаимодействие с металлами
+1 +6 -2 0 +2 +6 -2 0 H2SO4 + Sn = SnSO4 + H2↑ +1 -1 0 +2 -1 0
2HCl + Zn = ZnCl2 + H2↑
2) Взаимодействие с основными и амфотерными оксидами 2HI + MnO = MnI2 + H2O H2SO4 + Na2O = Na2SO4 + H2O 2HNO3 + ZnO = Zn(NO3)2 + H2O 6HCl + Al2O3 = 2AlCl3 + 3H2O
3) Взаимодействие с основными и амфотерными гидроксидами 2H3PO4 + 3Ca(OH)2 = Ca3(PO4)2↓ + 6H2O HCl + KOH = KCl + H2O H2SO4 + Zn(OH)2 = ZnSO4 + 2H2O 3HBr + Cr(OH)3 = CrBr3 + 3H2O
4) Взаимодействие с солями
СО2↑ Н2О
HCl + AgNO3 = AgCl↓ + HNO3
В последней реакции нарушается правило о том, что более сильная кислота вытесняет более слабую, но при этом выполняется условие протекания обменных реакций – выпадение осадка, нерастворимого в кислотах, поэтому реакция идет.
5) Разложение некоторых слабых кислот при нагревании При нагревании способны разлагаться такие слабые кислоты, как H2SiO3, H2CO3, H2SO3 t H2SiO3 = SiO2↓ + H2O t H2SO3 = SO2↑ + H2O
10. С чем могут реагировать металлы Как из одной соли получить другую соль (что добавить). Условия протекания обмен реакций, что такое обмен реакции, между какими классами веществ. Какие соли могут реагировать между собой. С чем только могут реагировать нерастворимые соли? Чтобы из одной соли получить другую соль, часто необходимо добавить другую соль, или кислоту, основание, но так, чтобы выполнялось условие протекания обмен реакций – газ осадок вода или слабый электролит Нужно получить NaNO3 из NaCl NaCl + AgNO3 = NaNO3 + AgCl↓ Обмен реакции протекают между солями кислотами и гидроксидами 2 соли могут реагировать между собой только если они обе растворимые иначе они не смогут обмениваться ионами так как не смогут распадаться на них. Нерастворимые соли могут раствориться только в сильных кислотах. 24. Что такое средние, кислые, основные соли, знать примеры. Средние NaCl K2CO3 Кислые NaHSO3 Основные CuOHCl Типы реакций Все химические реакции по характеру протекания делятся на несколько типов: Реакции соединения Реакции разложения Реакции замещения Реакции обмена 1) Реакция соединения – это реакция, при которой два или несколько простых или сложных веществ соединяются в одно сложное или более сложное вещество: N2 + 3H2 = 2NH3 CaO + CO2 = CaCO3 2) Реакция разложения – это реакция, при которой одно сложное вещество разлагается на два или несколько простых или менее сложных веществ. t Fe(OH)2 = FeO + H2O (буква t означает, что реакция протекает при нагревании) t CH4 = C + 2H2 3) Реакция замещения – это реакция, при которой атомы одного элемента или группа атомов вытесняет (замещает) атомы другого элемента или группу атомов.
Zn + 2HCl = ZnCl2 + H2 В данной реакции атом цинка Zn вытесняет (замещает) атомы водорода H. t CaCO3 + SiO2 = CaSiO3 + CO2 В данной реакции группа атомов элементов Si и О, а именно, оксид кремния SiO2 вытесняет (замещает) группу атомов элементов С и О, а именно, оксид углерода СО2. 4) Реакция обмена – это реакция, при которой два сложных вещества обмениваются ионами. Реакции обмена еще называют реакциями ионного обмена, так как в неё вступают только вещества, состоящие из ионов или способные распадаться на ионы, и обмен, соответственно, происходит ионами.
Гидроксиды, соли и кислоты способны распадаться на ионы. Эти классы веществ будут подробно рассмотрены в следующем разделе. 2+ -1 +1 -1 2+ -1 +1 -1 ZnCl2 + 2AgNO3 = Zn(NO3)2 + 2AgCl В данной реакции видно, что происходит обмен одноименно заряженными ионами, например, вместо Zn+2 встает Ag+. 2+ -1 +1 2- 2+ 2- Ca(OH)2 + H2SO4 = CaSO4 + 2H2O В данной реакции происходит обмен между ионами OH- и SO42-. Химические реакции могут протекать с изменением и без изменения степеней окисления. По данному признаку все реакции делятся на: Среда |
Индикатор | |||||||||||||||||||||||
| лакмус | фенолфталеин | метилоранж | |||||||||||||||||||||||
| нейтральная | фиолетовый | бесцветный | оранжевый | ||||||||||||||||||||||
| кислая | красный | бесцветный | красный | ||||||||||||||||||||||
| щелочная | синий | малиновый | желтый | ||||||||||||||||||||||
Свойства солей аммония
Все соли аммония представляют собой белые кристаллические вещества, хорошо растворимые в воде. Все соли аммония являются сильными электролитами и способны в растворе необратимо распадаться на ионы аммония NH4+ и ионы кислотного остатка:
 (NH4)2CO3 2NH4+ + CO32-
(NH4)2CO3 2NH4+ + CO32-
Все соли аммония способны разлагаться при нагревании:
(NH4)2CO3 = 2NH3↑ + CO2↑ + H2O
NH4Br = NH3↑ + HBr↑
Обратите внимание, что при нагревании нитрата и нитрита аммония протекает окислительно-восстановительные реакции в отличие от предыдущих:
|
|
-3 +1 +5 -2 +1 -2 +1 -2
NH4NO3 = N2O↑ + 2H2O
-3 +1 +3 -2 0 +1 -2
NH4NO2 = N2↑ + 2H2O
Соли аммония способны реагировать как с кислотами, так и с щелочами, при этом должно выполняться хотя бы одно из условий протекания обменных реакций:
(NH4)2S + 2HCl = H2S↑ + 2NH4Cl
NH4Cl + KOH = KCl + NH3↑ + H2O
По аналогичному принципу соли аммония могут реагировать с другими солями (при выпадении осадка):
2NH4I + Pb(NO3)2 = PbI2↓ + 2NH4NO3
Сероводород.
Сероводородная кислота образуется при растворении в воде сероводорода H2S. Сероводород H2S – газ при обычных условиях с характерным запахом тухлых яиц, токсичен, плохо растворим в воде.
Получение H2S.
1) Из простых веществ
0 0 t +1 -2
H2 + S = H2S
2) Взаимодействие сульфидов с сильными кислотами
ZnS + H2SO4 = ZnSO4 + H2S↑
Химические свойства H 2 S.
1) Диссоциация
H2S является слабой кислотой, поэтому плохо распадется на ионы и считается слабым электролитом.

 H2S 2H+ + S2-
H2S 2H+ + S2-
2) Взаимодействие с основными оксидами
H2S + CaO = CaS + H2O
3) Взаимодействие с основными гидроксидами
H2S + 2NaOH = Na2S + 2H2O
С амфотерными оксидами и гидроксидами сероводородная кислота реагирует плохо, так как все амфотерные оксиды и гидроксиды не растворимы, хорошо растворяются только в сильных кислотах, а H2S является слабой кислотой.
4) Взаимодействие с металлами
0 +1 -2 +2 -2 +1 -2
Ca + H2S = CaS + H2O
5) Взаимодействие с солями
H2S + Pb(CH3COO)2 = PbS↓ + 2CH3COOH
6) Взаимодействие с окислителями
Сера S в сероводородной кислоте H2S находится в минимальной степени окисления –2, поэтому H2S может проявлять только восстановительные свойства. H2S является сильным восстановителем, поэтому активно реагирует с окислителями.
+1 -2 +1 +6 -2 +4 -2 +1 -2
H2S + 3H2SO4 = 4SO2 + 4H2O
+1 -2 +2 -2 0 0 +1 -2
H2S + CuO = Cu + S + H2O
7) Восстановительные свойства сульфидов
Сульфиды – соли сероводородной кислоты, также являются сильными восстановителями.
+1 -2 +1 +7 -2 +1 -2 +1 +1 +6 -2 0 +1 -2 +1
Na2S + 2KMnO4 + 2KOH = 2K2MnO4 + S + 2NaOH
+1 -2 +1 -1 0 +1 -2 +1
K2S + H2O2 = S + 2KOH
Химические свойства HCl
1) Взаимодействие с металлами
0 +1 -1 2+ -1 0
Zn + 2HCl = ZnCl2 + H2↑
2) Взаимодействие с основными и амфотерными оксидами
Так как соляная кислота HCl является сильной кислотой, то она способна реагировать с веществами основного и амфотерного характера.
2HCl +CuO = CuCl2 + H2O
6HCl + Fe2O3 = 2FeCl3 + 3H2O
3) Взаимодействие с основными и амфотерными гидроксидами
|
|
HCl +NaOH = NaCl + H2O
3HCl + Fe(OH)3 = FeCl3 + 3H2O
4) Взаимодействие с солями
2HBr + K2S = 2KBr + H2S↑
Свойства азота
Молекулы азота состоят из 2-х атомов и имеют вид N2. Азот N2 при обычных условиях является газом без цвета и запаха, нерастворимым в воде. Имеет очень низкую температуру кипения. Газ азот безвреден для нашего организма. В воздухе содержится приблизительно 70% газа азота, поэтому азот ежесекундно попадает в наш организм, не представляя для человека никакой опасности. Это связано с тем, что азот является химически инертным газом, поэтому он не слишком охотно вступает в химическое взаимодействие. Это можно объяснить наличием тройной прочной ковалентной неполярной связи между атомами азота в молекуле:


 N N
N N
Соответственно, валентность атомов азота в молекуле равна III.
Получение азота N2 .
1) Промышленное получение
В промышленности азот N2 получают из воздуха путем сильного охлаждения и сжижения воздуха.
2) Лабораторное получение
Азот N2 в лаборатории можно получить разложением при нагревании таких солей, как нитрит аммония, бихромат аммония:
-3 +1 +3 -2 t 0 +1 -2
NH4NO2 = N2 + 2H2O
-3 +1 +6 -2 t 0 +3 -2 +1 -2
(NH4)2Cr2O7 = N2 + Cr2O3 + 4H2O
Химические свойства азота N 2.
1) Взаимодействие с металлами
Так как азот является очень инертным веществом, то способен реагировать при обычных условиях только с очень активными металлами (щелочными и щелочноземельными), так как они являются сильными восстановителями, при этом азот будет проявлять окислительные свойства:
0 0 +1 -3
N2 + 6Li = 2Li3N
2) Взаимодействие с неметаллами
Точно также азот способен реагировать только с очень активными неметаллами (сильными окислителями), при этом он будет проявлять восстановительные свойства:
0 0 t +3 -1
N2 + 3F2 = 2NF3
С кислородом азот практически не реагирует.
Азот N2 также способен сам проявлять окислительные свойства, реагируя с наименее активными неметаллами, например, с водородом. Азот N как химический элемент сам по себе является сильноэлектроотрицательным, поэтому должен проявлять сильные окислительные свойства, но этого не происходит за счёт образования прочной тройной связи между атомами азота в молекуле.
0 0 t -3 +1
N2 + 3H2 = 2NH3
Свойства фосфора
Фосфор является твёрдым хрупким аморфным веществом. В обычном состоянии существует 3 аллотропные модификации фосфора: белый, красный и черный фосфор.
Белый фосфор представляет собой белое воскообразное вещество, легко режется ножом, очень легкоплавкий, плохо растворим в воде. В темноте белый фосфор светится зеленым цветом. Белый фосфор имеет молекулярную формулу Р4, имеет молекулярную кристаллическую решетку. Белый фосфор химически очень активен и чрезвычайно ядовит.
При нагревании белого фосфора при 500 0С в бескислородной среде образуется красный фосфор. Красный фосфор представляет собой твёрдое вещество пурпурного цвета, имеющее металлический блеск, более устойчив и менее химически активен, чем белый фосфор. Плохо растворим в воде. Красный фосфор не представляет большой опасности для жизни и здоровья людей.
При нагревании красного фосфора образуется чёрный фосфор. Чёрный фосфор также можно получить из белого при нагревании и высоком давлении. Чёрный фосфор представляет собой чёрное вещество с металлическим блеском, нерастворимое в воде. Чёрный фосфор еще менее активен, чем красный, является полупроводником, поэтому способен проводить электрический ток.
Получение фосфора.
1) Сплавление фосфатов с углем и песком при высокой температуре
+2 +5 -2 +4 -2 0 t +2 +4 -2 +2 -2 0
Ca3(PO4)2 + 3SiO2 + 5C = 3CaSiO3 + 5CO↑ + 2P
Свойства серы.
Для элемента серы S также характерно явление аллотропии. Сера как элемент образует 3 простых вещества: ромбическая, моноклинная и пластическая сера. Наиболее устойчивая и распространенная форма – ромбическая сера S8, является твердым веществом, но имеет молекулярную кристаллическую решетку. Это хрупкое вещество желтого цвета, не растворимое в воде.
1) Взаимодействие с металлами
0 0 +1 -2
2K + S = K2S
0 0 +2 -2
Hg + S = HgS
Сера является средством против просыпанной ртути.
2) Взаимодействие с неметаллами
0 0 +4 -2
2S + C = CS2
0 0 +2 -2
S + Cl2 = SCl2
0 0 +4 -2
S + O2 = SO2
3) Взаимодействие с щелочами
0 +1 -2 +1 +1 +4 -2 +1 -2 +1 -2
3S + 6NaOH = Na2SO3 + 2Na2S + 3H2O
Жиры, белки, углеводы
Жиры – это сложные эфиры, образованные глицерином и жирными кислотами.
Жиры являются основными источниками энергии для многих животных, образуя подкожные жировые клетчатки, также выполняют строительную функцию, входят в состав клеточных мембран (фосфолипиды), рпедают эластичность костям и хрящам, образуют многие гормоны, например, женский гормон астроген.
При действии щелочей на жиры образуются соли жирных кислот (мыла) и глицерин, поэтому такие реакции называют омылением жиров. Жидкие жиры содержат остатки непредельных кислот (растительные жиры), а твердые жиры содержат остатки предельных кислот (животные жиры), и при пропускании водорода жидкие жиры переходят в твердые – этот процесс называется гидрогенизация, таким образом из дешевых растительных жиров получают дорогие твердые жиры, используемые как заменители молочного жира в продуктах питания.
Таблица жирных кислот
| Молекулярная формула | Краткая структурная формула | название | характер радикала |
| С17Н35СООН | CH3(CH2)16COOH | стеариновая кислота | предельная |
| С15Н31СООН | CH3(CH2)14COOH | пальмитиновая кислота | предельная |
| C17H33COOH | СН3(СН2)7СН=СН(СН2)7СООН | олеиновая кислота | непредельная |
| С17Н31COOH | СН3(СН2)3-(СН2-СН=СН)2-(СН2)7-СООН | линолевая кислота | непредельная |
| С17Н29COOH | СН3-(СН2-СН=СН)3-(СН2)7-СООН | линоленовая кислота | непредельная |
Белки являются природными биополимерами, содержат остатки аминокислот, имеют различную структуру: линейную (первичная),спиральную (вторичная), клубочную (глобулины) – третичная.
Белки содержатся в мясе, яйцах, рыбе, бобовых, морепродуктах. При варке идет разрушение вторичной и третичной структуры – этот процесс называется денатурацией белка. Белки имеют прочную структуру, обеспечивают строительную функцию – из белков построены мышцы, из белка коллагена состоят волосы и ногти, транспортную – перенос веществ в организме, защитную – имуноглобулины и т-фаги поедают и уничтожают вирусные тела. При сжигании белков образуется запах жженых перьев.
Углеводы – это кислородосодержащие органические соединения, общая формула которых Cn (H 2 O) m
Простейший углевод – глюкоза С6Н12О6. Входит в состав обычного сахара, который называется сахарозой. Является белым кристаллическим веществом, хорошо растворимым в воде, без запаха, имеет сладкий вкус, имеет в составе 5 гидроксильных групп и обладает свойствами многоатомных спиртов, а также имеет альдегидную группу и обладает также свойствами альдегидов.
Поэтому может реагировать с кислотами, гидроксидом меди, щелочными металлами, аммиачным раствором оксида серебра. В твердом виде образует циклическую форму. Входит в состав многих углеводов, таких как крахмал и целлюлоза. Углеводы как правило имеют энергетическую функцию и являются источниками энергии, содержатся в овощах, фруктах, растительных продуктах, крупах. Для растений еще выполняют и строительную функцию – образуют кору, клетчатку. Горят на воздухе, образуя СО2 и воду.
68. Взаимодействие солей меди и серебра, оксида и гидроксида меди и серебра с раствором аммиака, образование комплексных соединений.
Cu2O + 4NH3 + H2O = 2[Cu(NH3)2]OH
Ag2O + 4NH3 + H2O = 2[Ag(NH3)2]OH
Cu(OH)2 + 4NH3 = [Cu(NH3)4](OH)2
Соли меди и серебра также способны реагировать с раствором аммиака NH3 с образованием растворимых комплексных солей:
CuSO4 + 4NH3 = [Cu(NH3)4]SO4
AgCl + 2NH3 = [Ag(NH3)2]Cl
Ряд дополнительных вопросов.
69.
70. Какими металлами является Be и Mg
71. Взаимодействие перманганата калия и оксида марганца (4) с соляной кислотой.
72. Взаимодействие железной окалины с соляной кислотой и конц серной кислотой.
Ответы.
1. В периодах слева направо уменьшается радиус атома, нарастают окислительные и неметаллические свойства и электроотрицательность, соответственно, уменьшаются восстановительные и металлические свойства.
В группах сверху вниз нарастают восстановительные и металлические свойства, увеличивается радиус атома, соответственно, уменьшаются окислительные и неметаллические свойства и электроотрицательность
2. По номеру периода можно определить число энергетических уровней в элементе, по номеру группы – его высшую валентность и число электронов на внешнем уровне, также максимальную положительную степень окисления. Например, азот N, находится в пятой группе, его максимальная валентность V, число внешних электронов 5, если он отдаст все пять электронов с внешнего уровня, его максимальная степень окисления будет равна +5, также ему не хватает до завершения внешнего уровня взять 3 электрона, тогда его степень окисления будет равна -3, или отдать 5 электронов, тогда степень окисления будет +5
3. Окислитель – тот кто берет электроны, Восстановитель – тот кто отдает электроны. Окислитель берет электроны и восстанавливается тем самым (восстановление процесс принятия электронов). Восстановитель отдает электроны тем самым он окисляется (окисление процесс отдачи электрона) Легче запомнить кто такой окислитель и восстановитель а процессы характерные им имеют противоположные названия.
Окислители берут электроны и степень окисления их понижается засчет отрицательного заряда электронов, а восстановители отдают электроны и повышают свою степень окисления, так как они отдают минусы
Металлы – только восстановители, и имеют поэтому только положительные степени окисления, а неметаллы могут быть и окислителями и восстановителями, поэтому могут иметь как положительные та и отрицательные степени окисления, кроме фтора, так как фтор – только окислитель, и он самый сильный окислитель.
4. Виды химических связей:
Ковалентная связь
Ионная связь
Металлическая связь
Водородная связь
Ковалентная связь возникает при образовании общих электронных пар. Ковалентная связь возникает только у неметаллов и бывает 3-х видов: ковалентная неполярная, ковалентная полярная и ковалентная связь с донорно-акцепторным механизмом.
Ковалентная неполярная связь образуется между атомами неметаллов с одинаковой электроотрицательностью (Э.О.), то есть между атомами одного химического элемента Cl2 H2 P N2
Ковалентная полярная связь возникает между атомами неметаллов с разной электроотрицательностью. HCl H2O BF3
Донорно-акцепторная связь присутствует в ионе аммония NH4+
Ионная связь образуется между атомами металла и неметалла. Данный вид связи характерен для всех оксидов металлов (ZnO, Na2O, Fe2O3, CaO), для всех солей, так как там присутствуют связи «металл – неметалл» (CaCl2, NaF, CuSO4, Ag3PO4).
Металлическая связь характерна для всех простых металлов (K, Ba, Mn, Pb и т.д.)
Водородная связь в большинстве случаев образуется между молекулами, то есть, преимущественно, является межмолекулярной связью. Водородная связь – это связь, образующаяся между атомом водорода H одной молекулы и сильно электроотрицательным элементом другой молекулы. Водородная связь образуется между молекулами галогенводородов (HCl, HBr, HI), воды H2O, спиртов, минеральных и органических (карбоновых) кислот.
По виду частиц, которые существуют в веществе, кристаллическую решётку разделяют на 4 типа:
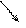
 2HCl + CaCO3 = CaCl2 + H2CO3
2HCl + CaCO3 = CaCl2 + H2CO3


