Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
А. Механизм действия липофильных гормоновСодержание книги
Поиск на нашем сайте
К липофильным сигнальным веществам принадлежат все стероидные гормоны, тироксин. Местом действия этих биорегуляторов являются ядра клеток-мишеней. В крови липофильные гормоны обычно бывают связаны с транспортными белками крови. Однако через плазматическую мембрану проникает лишь свободный гормон. В цитоплазме или в клеточном ядре гормон взаимодействует со специфическим рецептором. Рецепторы гормонов принадлежат к группе редких белков. Они присутствуют в клетках-мишенях и характеризуются высоким уровнем сродства к гормону и высокой избирательностью. Связывание гормона влечет за собой конформационную перестройку молекулы рецепторного белка, сопряженного с другими белками, диссоциацию с освобождением от белков-ингибиторов, и образование димеров, обладающих повышенным сродством к ДНК. Ключевой стадией процесса гормональной регуляции является связывание димеров гормон-рецепторного комплекса с двунитевой ДНК. Комплекс связывается с регуляторными участками генов, которые носят название гормон-респонсивные элементы (ГРЭ). Они выполняют функции усилителей транскрипции. Каждый гормон-рецепторный комплекс узнает собственный участок связывания и инициирует транскрипцию лишь одного контролируемого этим участком гена.
Б. Рецепторы липофильных гормонов Рецепторы липофильных сигнальных веществ во многом сходны, так как принадлежат к одному семейству белков. Молекула рецепторного белка включает несколько доменов.имеющих различные размеры и выполняющих разные функции. В молекуле имеется регуляторный и ДНК-связывающий домены, а также небольшой сайт-специфичный и гормонсвязывающий домены.
Гормоны поджелудочной железы(инсулин,глюкагон).:обр-ие,влияние на обмен в-в и утилизация. Инсулин Молекула инсулина, содержащая 51 аминокислотный остаток, состоит из двух полипептидных цепей, соединенных между собой в двух точках дисульфидными мостиками. В настоящее время принято обозначать цепью А инсулина 21-членный пептид и цепью В – пептид, содержащий 30 остатков аминокислот. Биосинтез инсулина осуществляется в β-клетках панкреатических островков. 1. На рибосомах шероховатой эндоплазматической сети синтезируется препроинсулин, построенный из 110 аминокислотных остатков. 2. Почти сразу после синтеза в ЭПС от этой молекулы отщепляется сигнальный (L) пептид — последовательность из 23 аминокислот, которые необходимы для прохождения синтезируемой молекулы через гидрофобную липидную мембрану ЭПС. Образуется проинсулин, который транспортируется в комплекс Гольджи, далее в цистернах которого происходит так называемое созревание инсулина. 3. В процессе созревания из молекулы проинсулина с помощью специфических эндопептидаз вырезается C-пептид — фрагмент из 33 аминокислоты, соединяющий B-цепь и A-цепь.
Различают две формы инсулина: 1) свободную, стимулирующую усвоение глюкозы мышечной и жировой тканями; 2) связанную, активную только в отношении жировой ткани. В настоящее время доказано существование связанной формы инсулина и установлена локализация ее в белковых фракциях сыворотки крови, в частности в области трансферринов и α-глобулинов.
Он участвует в регуляции метаболизма, транспорта глюкозы, аминокислот, ионов, в синтезе белков. Инсулин влияет также на процессы репликации и транскрипции, участвуя таким образом в регуляции клеточной дифференцировки, пролиферации и трансформации клеток. У экспериментальных животных введение инсулина вызывает гипогликемию, увеличение запасов гликогена в мышцах, усиление анаболических процессов, повышение скорости утилизации глюкозы в тканях. Кроме того, инсулин оказывает опосредованное влияние на водный и минеральный обмен. Влияние инсулина на метаболизм глюкозы. Инсулин стимулирует утилизацию глюкозы в клетках разными путями. Влияние инсулина на метаболизм глюкозы осуществляется путём повышения активности и количества ключевых ферментов гликолиза: глюкокиназы, фосфофруктокиназы, пируваткиназы. Кроме того, инсулин активирует фосфатазы, дефосфорилирующие гликогенсинтазу, в результате чего происходит активация синтеза гликогена и тормозится его распад. Влияние инсулина на метаболизм жиров. В печени и жировой ткани инсулин стимулирует синтез жиров. В адипоцитах инсулин активирует ацетил КоА-карбоксилазу и ЛП-липазу и индуцирует синтез синтазы жирных кислот, ацетил-КоА-карбоксилазы и ЛП-липазы. Инсулин в жировой ткани тормозит мобилизацию жиров. Он активирует фосфатазу, которая дефосфорилирует и тем самым инактивирует гормончувствительную ТАГ-липазу.
Повышение содержания глюкозы в крови вызывает увеличение секреции инсулина в панкреатических островках, а снижение ее содержания, наоборот,– замедление секреции инсулина. При недостаточной секреции инсулина развивается сахарный диабет. Помимо клинически выявляемых симптомов (полиурия, полидипсия и полифагия), сахарный диабет характеризуется рядом специфических нарушений процессов обмена. Так, у больных развиваются гипергликемия и гликозурия, наблюдается усиленный распад гликогена в печени и мышцах, замедление биосинтеза белков и жиров, снижение скорости окисления глюкозы в тканях, развитие отрицательного азотистого баланса, увеличение содержания холестерина и других липидов в крови. При диабете усиливаются мобилизация жиров из депо, синтез углеводов из аминокислот (глюконеогенез) и избыточный синтез кетоновых тел (кетонурия). У экспериментальных животных введение инсулина вызывает гипогликемию, увеличение запасов гликогена в мышцах, усиление анаболических процессов, повышение скорости утилизации глюкозы в тканях. Кроме того, инсулин оказывает опосредованное влияние на водный и минеральный обмен.
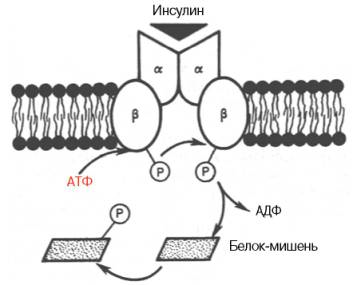
Получены доказательства существования специфического рецептора инсулина на внешней плазматической мембране почти всех клеток организма, а также образования инсулинрецепторного комплекса. Рецептор синтезируется в виде предшественника – полипептида, который далее расщепляется на α-и β-субъединицы, связанные дисульфидными связями. α-субъединицы почти целиком располагаются на внешней стороне биомембраны, выполняя функцию связывания инсулина клетки, β-субъединицы представляют собой трансмембранный белок, выполняющий функцию преобразования сигнала.
Глюкагон - одноцепочечный полипептид, состоящий из 29 аминокислотных остатков. Биосинтез глюкагона происходит в α-клетках островков Лангерханса. Неактивный предшественник проглюкагон в результате частичного протеолиза превращается в несколько пептидов. В клетках поджелудочной железы главный пептид - глюкагон. При приёме пищи, богатой углеводами, секреция глюкагона снижается. Белковая пища стимулирует секрецию инсулина и глюкагона; однако некоторые аминокислоты в большей степени влияют на секрецию одного из них. Например, аланин стимулирует секрецию глюкагона, но не инсулина. В плазме крови глюкагон не связан с каким-либо транспортным белком. T1/2 гормона составляет ~5 мин. В печени глюкагон быстро разрушается под действием специфических протеаз. Эффекты глюкагона в основном противоположны эффектам инсулина. Основные клетки-мишени глюкагона - печень и жировая ткань. Связываясь с рецепторами на плазматической мембране клеток-мишеней, глюкагон повышает содержание цАМФ. В гепатоцитах это приводит к активации фосфорилазы гликогена и к снижению активности гликогенсинтазы. В результате ускоряется мобилизация гликогена. Фосфорилирование пируваткиназы и БИФ вызывает торможение гликолиза и ускорение глюконеогенеза. Кроме того, глюкагон стимулирует глюконеогенез, индуцируя синтез ферментов: глюкозо-6-фосфатазы, фосфоенол-пируваткарбоксикиназы, фруктозо-1,6-бисфосфатазы. В клетках жировой ткани глюкагон стимулирует липолиз. Таким образом, в противоположность инсулину глюкагон стимулирует мобилизацию основных энергоносителей - углеводов и жиров. 97. Биохимия сахарного диабета в 96 вопросе!
|
||||
|
Последнее изменение этой страницы: 2021-05-27; просмотров: 83; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.144.21.237 (0.008 с.) |