

Мы поможем в написании ваших работ!
ЗНАЕТЕ ЛИ ВЫ?
|
Методы идентификации и разделения аминокислот
Содержание книги
- Структура и функция аминокислот с полярным (заряженным положительно) радикалом. Роль радикалов гистидина в гемоглобине и ферментах. Роль радикалов лизина в структурах коллагена и эластина. Гистоны.
- Методы идентификации и разделения аминокислот
- Химическая модификация аминокислотных радикалов в белках и их роль в построении структуры и функции белков.
- Структура и функции сложных белков: гликопротеиды, протеогликаны, нуклеопротеиды, фосфопротеиды, липопротеиды, хромопротеиды, металлопротеиды.
- Регуляция активности ферментов: неспецифическая, аллостерическая, регуляция на уровне индукции и репрессии, гормональная регуляция.
- Распределение ферментов в клетках, тканях, органах и биологических жидкостях. Мультиферментные комплексы, преимущества организации
- Наследственные энзимопатии - это заболевания, вызванные наследственными нарушениями биосинтеза ферментов или их структуры и функции.
- Структура, классификация и роль углеводов в организме, пищеварение в жкт у новорождённых и детей более старших возрастов, всасывание продуктов гидролиза
- Биологическая роль углеводов
- Аэробный гликолиз: стадия, ферменты и коферменты, биоэнергетика значение для организма. Челночные механизмы транспорта атома водорода в митохондрии и их роль в поддержании аэробного гликолиза.
- Пути вхождения углеводов в гликолиз. Полное окисление фруктозы (начиная с фруктокиназной реакции). Биоэнергетика процесса, фруктозурия.
- Гликогенез и гликогенолиз в печени. Роль печени в поддержании нормального уровня глюкозы в крови.
- Роль печени в поддержании нормального уровня содержания глюкозы в крови.
- Наследственные патологии углеводного обмена: гликогенозы, фруктозурия, галактоземия, непереносимость лактозы и др.
- Липиды организма: классификация, строение, физико-химические свойства, биологическая роль. Пищеварение липидов в жкт новорожденных
- Энтерогепатический цикл холестерола и желчных кислот.
- Синтез гликогена из глицерола в печени.
- Использование кетоновых тел .
- Роль гормонов в регуляции липидного обмена. Патология липидного обмена (жировая инфильтрация печени, атеросклероз, ожирение, наследственные заболевания), причины возникновения и последствия.
- Мембрана эндоплазматического ретикулума (ЭР)
- Переваривание белков в жкт, биосинтез соляной кислоты и пепсиногена в желудке. Протеазы панкреаса и кишечника. Активирование зимогенов в жкт, специфика действия каждой из протеаз.
- Метаболизм аргинина. Окисление аргинина до конечных продуктов, биоэнергетика процесса. Орнитиновый цикл.
- Интеграция обмена аминокислот с обменом других соединений. Синтез глюкозы из глутамата в печени.
- Метаболизм амидного азота глутамина в почках
- Наследственные патологии обмена фенилаланина, тирозина,лейцина,цистеина. Изменения в белковом обмене при сахарном диабете
- Обмен хромопротеидов: синтез и распад гемма. Обтурационная, паренхиматозная и гемолитическая желтуха. Порфирии.
- Обмен нуклеопротеидов: синтез и распад пуринов.
- Этапы реализации генетической информации: репликация, транскрипция, трансляция.
- Особенности метаболизма лейкоцитов.
- Свертывание крови: внешние и внутренние пути.
- Перенос углекислого газа кровью от тканей к легким
- Гипоксия при патологических процессах, нарушающих снабжение или утилизацию кислорода тканями.
- Нарушения кислотно-основного равновесия
- Нарушения общего объема крови
- Патологические изменения эритроцитов
- Распределение в организме и участие в бихимических реакциях мкро и микроэлементов: наприя,калия, кальция,магния,кобольта,железа,цинка,фосфора,хлора и фтора.
- А. Механизм действия гидрофильных гормонов
- А. Механизм действия липофильных гормонов
- Гормоны щитовидной железы,влияние на обмен в-в. Гипо и гипертиреозы. Механизмы возникновения и последствия.
Похожие статьи вашей тематики
Электрофорез основан на различии в скорости движения белков в электрическом поле, которая определяется величиной заряда белка при определенных значениях рН и ионной силы раствора. Применяется в клинической медицине для анализа белковых и пептидных смесей, сыворотки крови. В последнее время более широкое распространение получили методы зонального электрофореза белков на различных носителях, в частности на твердых поддерживающих средах: гелях крахмала и полиакриламида, целлюлозе.
Хроматография - физико-химический метод разделения и анализа смесей веществ, основанный на распределении их компонентов между двумя несмешивающимися фазами – неподвижной и подвижной.
Различают следующие разновидности хроматографии:
- адсорбционная - разделение компонентов смеси основано на их различной сорбируемости на твердом адсорбенте;
- распределительная - твердая фаза служит опорой для стационарной жидкой фазы. Разновидностью является хроматография на бумаге;
- ионообменная - используют подходящую ионообменную смолу, с функциональными группами которой обменивается и задерживается на колонке часть белков, в то время как другие белки беспрепятственно элюируются с колонки;
- гель-хроматография, или метод молекулярных сит, основан на способности небольших молекул проникать в поры геля, тогда как большие молекулы остаются снаружи, двигаясь вместе с подвижной фазой вниз вдоль колонки. Позволяет разделить белки с разной молекулярной массой.
Перспективными видами хроматографии являются высокоэффективная жидкостная хроматография (ВЭЖХ) и г азовая хроматография. Хроматография является одним из основных методов биохимических исследований. В клинических лабораториях ее применяют для разделения и анализа аминокислот, белков, углеводов, фосфолипидов, стероидов в плазме крови, тканевых экстрактах, моче.
6. Напишите структуру пентапептида следующего состава: фен-про-асп-цис-вал. Определите заряд пептида при PH =7;1,5;12. Напишите план мероприятий по определению первичной структуры данного пептида.
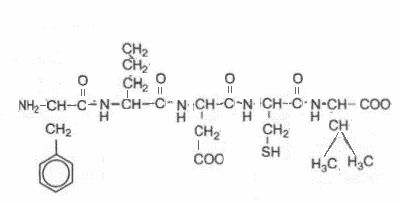
рН=7 = -1
рН=1,5 = +1
рН=12 = -2
шесть основных стадий:
Стадия 1, - определение аминокислотного состава.
гидролиз всех пептидных связей чистого полипептида. Образующаяся смесь аминокислот анализируется затем при помощи ионообменной хроматографии, что позволяет определить, какие аминокислоты и в каком соотношении присутствуют в гидролизате.
Стадия 2, - идентификация амино- и карбокси- концевых остатков.
идентификация аминокислотного остатка, находящегося на конце полипептидной цепи, несущего свободную альфа-аминогруппу,т.е. на аминоконце (NH2 - конце, или N-конце). Карбоксиконцевой (С- концевой) аминокислотный остаток тоже можно идентифицировать. Один из таких методов состоит в инкубировании полипептида с карбоксипептидазой, которая гидролизует только пептидную связь находящуюся на карбоксильном конце (С-конце) цепи. Определив, какая из аминокислот первой отщепилась от полипептида, при действии на него карбоксипептидазы, можно идентифицировать С-концевой остаток.
Стадия 3, - расщепление полипептидной цепи на фрагменты.
Наиболее распространенный метод для проведения такого расщепления - это частичный ферментативный гидролиз пептида под воздействием пищеварительного фермента трипсина. Этот фермент обладает высокой специфичностью действия: гидролизу подвергаются только те пептидные связи, которые образованы между карбоксильной группой лизина или аргинина и аминогруппой любой аминокислоты.
Стадия 4, - определение последовательности пептидных фрагментов
На этой стадии устанавливается аминокислотная последовательность в каждом из пептидных фрагментов, полученных на стадии 3.
Стадия 5,- расщепление исходной полипептидной цепи еще одним способом
Чтобы установить порядок расположения пептидных фрагментов, образовавшихся под действием трипсина, берут новую порцию препарата исходного полипептида и расщепляют его на более мелкие фрагменты каким-либо другим способом, при помощи которого расщепляются пептидные связи устойчивые к действию трипсина. Для этой цели предпочтительнее оказывается на химические методы.
Стадия 6, - установление порядка расположения пептидных фрагментов по перекрывающимся фрагментам.
Аминокислотные последовательности в пептидных фрагментах, полученных двумя способами, сравнивают, чтобы во втором наборе найти пептиды, в которых последовательности отдельных участков совпадали бы с последовательностями тех или иных участков пептидов первого набора. Пептиды из второго набора с перекрывающимися участками позволяют соединить в правильном порядке пептидные фрагменты, полученные в результате первого расщепления исходной полипептидной цепи.
|