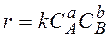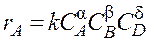Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Зависимость скорости химических реакций от концентрации реагентов. Кинетические уравненияСодержание книги
Поиск на нашем сайте
Скорость химического превращения зависит от большого числа переменных. Результаты экспериментальных исследований различных реакций показали, что на скорость влияют не только факторы, определяющие состояние химического равновесия (температура, давление, состав реакционной системы), но и иные причины, такие, как наличие или отсутствие посторонних веществ, не претерпевающих изменений в результате реакции, условия физической транспортировки реагентов к реакционным центрам и др. Факторы, оказывающие влияние на скорость химического превращения, обычно подразделяют на две группы: 1. Чисто кинетические (микрокинетические), определяющие скорость взаимодействия на молекулярном уровне. 2. Макрокинетические, определяющие влияние на скорость реакции условий транспорта реагентов к зоне реакции, наличия или отсутствия перемешивания, геометрических размеров реактора. Закон действующих масс: скорость простой гомогенной химической реакции прямо пропорциональна произведению концентраций реагирующих веществ. Постулат о независимости элементарных превращений: вероятность того, что с данной частицей нечто происходит в данный момент времени, не зависит ни от того, что происходит в те же моменты времени с другими частицами, ни от того, что происходит с данной и другими частицами в другие моменты времени. Функциональная зависимость скорости химической реакции от концентраций компонентов реакционной смеси называется кинетическим уравнением реакции. В химической кинетике принято делить химические реакции на элементарные и неэлементарные (сложные). Элементарными(одностадийными) называются реакции, осуществление которых связано с преодолением одного энергетического барьера при переходе из одного состояния реакционной системы в другое. Механизм такой реакции соответствует ее стехиометрическому уравнению. Кинетическое уравнение необратимой элементарной реакции аА + bB в соответствии с законом действующих масс, имеет вид
Коэффициент пропорциональности k,входящий в кинетическое уравнение, называют константой скорости химической реакции. Целочисленные показатели степени а и b уконцентраций реагентов А и В в кинетическом уравнении для элементарной реакции называются порядками реакции по реагентам соответственно А и В. Их сумма а + b = n называется общим порядком реакции. Для элементарных реакций частные порядки (порядки реакций по отдельным реагентам) равны соответствующим стехиометрическим коэффициентам в уравнении реакции. Наряду с понятием «порядок реакции» в химической кинетике используют понятие «молекулярность реакции». Молекулярность реакции равняется минимальному числу молекул, одновременно принимающих участие в одном элементарном акте реакции. Для элементарных реакций порядок равен молекулярности и может иметь значения 1, 2, 3. Порядок (или молекулярность) элементарных реакций не превышает значения 3, так как вероятность одновременного столкновения более чем трех молекул чрезвычайно низка. Однако большинство химических реакций не являются элементарными: они протекают через ряд промежуточных стадий. Стехиометрическое уравнение неэлементарной (сложной) реакции отражает лишь начальное и конечное состояния данной реакционной системы и не описывает механизм реакции. Сложную реакцию иногда удобно рассматривать как формально простую,т. е. считать, что она протекает в одну, а не в несколько стадий. Так можно поступить, если в условиях рассматриваемой задачи промежуточные продукты не обнаруживаются. Для формально простой реакции аА + bВ + dD кинетическое уравнение по аналогии с простой (элементарной) реакцией можно записать в следующем виде:
где частные порядки реакции α, β и δ находят экспериментально. В общем случае α ≠ a,β ≠ b, δ ≠ d,т. е. молекулярность и порядок реакции не совпадают. Полный порядок реакции п = α + β + δ и частные порядки в таком уравнении могут быть целочисленными, но могут быть и дробными, так как закон действующих масс, предполагающий целочисленные показатели степеней у концентраций в кинетическом уравнении, строго применим только к элементарным реакциям. Наряду с неэлементарными реакциями, которые можно рассматривать как формально простые, существует много сложных реакций, которые явно распадаются на стадии (продукты различных стадий образуются в значительных количествах). Простейшими типами сложных реакций являются параллельные и последовательные реакции. В параллельных реакциях взаимодействие одних и тех же реагентов может протекать по различным реакционным путям с образованием различных продуктов. В последовательных реакциях продукт первой реакции является исходным реагентом для второй. Реакция может состоять как из двух, так и из большего числа стадий, следующих друг за другом. Примером таких реакций могут служить реакции расщепления углеводородов с длинной углеродной цепочкой на все более мелкие молекулы. В случае если известен механизм сложной реакции (элементарные стадии, через которые она протекает), скорость реакции по одному из веществ – ее участников – равна алгебраической сумме скоростей тех элементарных стадий, в которых это вещество принимает участие.
|
||||
|
Последнее изменение этой страницы: 2021-04-04; просмотров: 142; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.147.60.62 (0.011 с.) |

 rR + sS
rR + sS