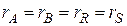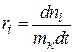Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Использование законов химической кинетики при выборе технологического режима и моделировании химических процессовСодержание книги
Поиск на нашем сайте
Решающее значение при выборе условий проведения химико-технологических процессов имеют вопросы скорости химических превращений, изучаемые химической кинетикой. Для химической технологии важен конечный результат кинетических исследований – конкретный вид уравнения, позволяющего рассчитывать скорость химической реакции при различных условиях ее проведения. Кинетические уравнения, содержащие необходимую информацию об основных закономерностях химических превращений, являются первоосновой математической модели химического реактора. Без знания кинетических закономерностей невозможно правильно выбрать тип реактора и рассчитать его конструктивные размеры. Вопросы изучения кинетики химических реакций, определения кинетических параметров подробно рассматриваются в руководствах по физической химии и химической кинетике. Здесь основное внимание будет обращено на практические приложения результатов кинетических исследований. Химическая кинетика решает следующие задачи, перечисленные в порядке сложности их решения:
Формальная кинетика — это раздел кинетики, рассматривающий временной ход превращений вне связи с конкретной природой объектов, участвующих в превращении. Для формальной кинетики важна лишь математическая форма уравнений, описывающих кинетику превращения, но не детальная природа превращения.
Скорость химических реакций
Скорость простой гомогенной химической реакции равна числу элементарных химических актов, протекающих в единице объема за единицу времени. Скорость химической реакции принято выражать количеством (моль) одного из реагентов или продуктов, прореагировавшим (или образовавшимся) в единицу времени в единице реакционного пространства. Скорость химической реакции может быть измерена по любому компоненту, участвующему в реакции. Она всегда положительна, поэтому знак перед производной dn i /d t должен определяться тем, является ли вещество i исходным реагентом (тогда dn i /d t отрицательна) или продуктом (тогда dn i /d t положительна). Иногда нельзя определенно сказать, является ли вещество i реагентом или продуктом. Например, при протекании последовательных реакций A R вещество R является продуктом по отношению к первой стадии и реагентом по отношению ко второй. В этом случае необходимо, чтобы знак перед производной находился в определенном соответствии со знаками в кинетическом уравнении. В том случае, если реакция протекает при постоянном объеме, скорость определяют как изменение концентрации в единицу времени: Если химическая реакция описывается стехиометрическим уравнением
то изменения количеств реагентов и продуктов, в результате ее протекания связаны между собой соотношениями: Скорости реакции, определенные по изменению количества различных реагентов в соответствии с уравнениями (1) или (2), количественно различаются между собой, если не равны стехиометрические коэффициенты у этих реагентов. В то же время из уравнений (2) и (3) следует, что для скоростей реакции, рассчитанных по изменению количества разных реагентов или продуктов, будет выполняться условие
Такая ситуация создает некоторые неудобства в количественном определении скорости реакции, так как измеренная по изменению количеств различных реагентов скорость одной и той же реакции будет выражаться различными числовыми значениями. Для устранения этого неудобства далее будем определять скорость реакции по уравнению:
Экспериментально скорость химической реакции определяют, изучая изменение во времени количества (или концентрации) некоторого реагента или продукта. Численно скорость реакции выражают в единицах концентрации, отнесенных к единице времени, например: кмоль·м–3·ч–1; моль·л–1·с–1 и т. д. Для гетерогенно-каталитических процессов, где химические реакции протекают на поверхности катализатора, которая в большинстве случаев неизвестна, скорость превращения вещества относят к единице массы катализатора:
|
||||
|
Последнее изменение этой страницы: 2021-04-04; просмотров: 209; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.144.90.108 (0.006 с.) |

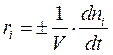 (1)
(1) 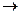 R,
R,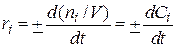 (2)
(2)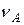 А +
А +  B
B 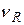 R +
R + 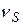 S,
S,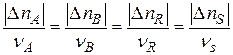 (3)
(3)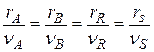
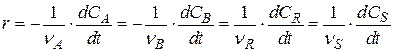 (4)
(4)