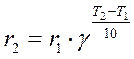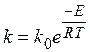Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Способы изменения скорости простых и сложных реакцийСодержание книги
Поиск на нашем сайте
Скорость химической реакции зависит от большого числа различных факторов. Из кинетических уравнений следует, прежде всего, что скорость простой реакции пропорциональна концентрациям веществ, являющихся реагентами в данной реакции. Следовательно, для простых реакций увеличение концентрации исходных веществ практически всегда приводит к увеличению скорости (за исключением реакций нулевого порядка, скорость которых не зависит от концентрации). Если реакция, описываемая стехиометрическим уравнением аА + bB Для сложных реакций, в частности для параллельных, вопрос о выборе концентраций реагентов для управления процессом также не является однозначным. Рассмотрим для примера систему из двух параллельных реакций разного порядка (при постоянной температуре): Говоря об увеличении скорости такой реакции, нужно сначала решить, какая реакция более важна, т. е. какая реакция приводит к образованию нужного целевого продукта. Нас интересует чаще всего не то, насколько быстро израсходуется реагент А, а насколько быстрее будет образовываться целевой продукт по сравнению с побочным. Пусть в рассматриваемом примере целевым является продукт первой реакции R, а побочным – продукт S. Для анализа соотношения скоростей целевого и побочных процессов пользуются мгновенной, или дифференциальной, селективностью, равной отношению скорости расходования реагента А на целевую реакцию к общей скорости расходования реагента и на целевую, и на побочные реакции. Значение дифференциальной селективности в ходе процесса в общем случае не остается постоянным, так как оно определяется отношением скоростей реакций, а скорость реакции по мере ее протекания меняется. Таким образом, дифференциальная селективность характеризует эффективность целевой реакции в некоторый момент времени при некотором значении концентраций реагентов и продуктов и при заданной температуре. Лишь в том случае, когда параметры процесса во времени и пространстве не меняются (это возможно при проведении процесса в стационарном реакторе идеального смешения), φ остается постоянной величиной. При протекании химической реакции меняются концентрации реагентов и продуктов. Рассмотрим, как при изменении концентрации исходного реагента А для системы параллельных реакций при постоянной температуре процесса меняется дифференциальная селективность φ. Пусть целевая реакция имеет по исходному реагенту А порядок n 1, а побочная реакция – п 2,тогда
Проанализируем зависимость φ от концентрации реагента А. Для удобства преобразуем выражение:
Здесь Очевидно, что φ может быть как возрастающей, так и убывающей функцией от концентрации. Определим характер функции φ(СА) по знаку первой производной:
Как видно из уравнения, знак первой производной зависит от знака В этом случае желаемый результат – увеличение скорости образования целевого продукта R по сравнению со скоростью образования побочного продукта S (увеличение дифференциальной селективности φ) – достигается при использовании исходного реагента высокой концентрации.
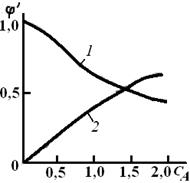
Рис. 3.1. Зависимость дифференциальной селективности от концентрации исходного реагента А для параллельных реакций при различных соотношениях порядков реакций n 1 и п 2: 1 – п 1 = 1, k 1=10 ч–1; n 2=2,5, k 2=15 м4,5/(кмолъ1,5·ч);
При ∆n > 0 (n 1 < п 2)характер зависимости φот концентрации исходного реагента противоположный: d φ /dСA < 0, следовательно, φ(СА) – убывающая функция (кривая 1),и более высокая дифференциальная селективность по целевому продукту достигается при низкой концентрации исходного реагента. Следовательно, не всегда выгодно стремиться увеличивать концентрацию реагента. Правда, при низких концентрациях реагента небольшим будет абсолютное значение скорости при прочих равных условиях. Тогда нужно искать другие пути увеличения скорости реакции при сохранении высокого значения дифференциальной селективности. При ∆n = 0 дифференциальная селективность, как это видно из уравнения, остается постоянной величиной при любых значениях концентрации исходных реагентов, и изменить φ можно, лишь изменив соотношение k 2 /k 1. Проще всего можно повлиять на это соотношение, изменив температуру проведения реакции, так как температура является одним из технологических параметров, в наибольшей степени влияющим на скорость химической реакции. Рассмотрим влияние температуры на скорость химической реакции более подробно. Экспериментально при изучении кинетики химических реакций было обнаружено, что при увеличении температуры на 10 градусов скорость реакции возрастает в 2–4 раза:
Более строго эта зависимость выражается в виде уравнения Аррениуса:
где k – константа скорости реакции; k 0– предэкспоненциальный множитель (предэкспонента); Е – энергия активации реакции; R – универсальная газовая постоянная; Т – температура. Превращение исходных частиц в продукты реакции, как правило, связано с преодолением потенциального барьера, который называют энергией активации химической реакции (Е).
|
||||
|
Последнее изменение этой страницы: 2021-04-04; просмотров: 188; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.12.152.102 (0.01 с.) |

 rR + sS, характеризуется различающимися частными порядками по компонентам А и В, наибольшее влияние на скорость реакции будет оказывать изменение концентрации реагента, имеющего больший частный порядок. Например, если кинетическое уравнение реакции, в которой участвуют два реагента, имеет вид
rR + sS, характеризуется различающимися частными порядками по компонентам А и В, наибольшее влияние на скорость реакции будет оказывать изменение концентрации реагента, имеющего больший частный порядок. Например, если кинетическое уравнение реакции, в которой участвуют два реагента, имеет вид 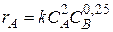 , то увеличение концентрации реагента А в 2 раза вызовет рост скорости в 4 раза, а двукратное повышение концентрации реагента В приведет к возрастанию скорости лишь в 1,19 раза.
, то увеличение концентрации реагента А в 2 раза вызовет рост скорости в 4 раза, а двукратное повышение концентрации реагента В приведет к возрастанию скорости лишь в 1,19 раза.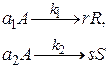
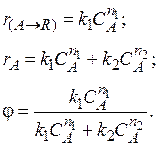
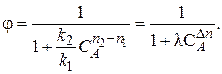
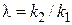 – величина, не зависящая от концентрации реагента A; n = п 2 – п 1– разность порядков побочной и целевой реакций по исходному реагенту А.
– величина, не зависящая от концентрации реагента A; n = п 2 – п 1– разность порядков побочной и целевой реакций по исходному реагенту А.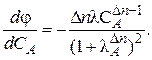
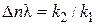 – всегда положительного, СA в любой степени также положительная величина. Если ∆n < 0, т. е. если n 1 > п 2(порядок целевой реакции по исходному реагенту больше порядка побочной реакции), то φ(Са) – возрастающая функция; скорость целевой реакции с ростом концентрации исходного реагента возрастает значительно быстрее скорости побочной реакции и доля скорости целевой реакции в суммарной скорости возрастает (кривая 2).
– всегда положительного, СA в любой степени также положительная величина. Если ∆n < 0, т. е. если n 1 > п 2(порядок целевой реакции по исходному реагенту больше порядка побочной реакции), то φ(Са) – возрастающая функция; скорость целевой реакции с ростом концентрации исходного реагента возрастает значительно быстрее скорости побочной реакции и доля скорости целевой реакции в суммарной скорости возрастает (кривая 2).