Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Хирургическая анатомия пищевода
Пищевод представляет собой полый мышечный орган и является частью пищеварительного канала между глоткой и желудком. Стенка пищевода состоит из нескольких слоев: слизистой, подслизистой, мышечного слоя и адвентиции. Абдоминальный отдел пищевода может быть покрыт серозой. Мышечная оболочка представлена двумя слоями: наружным - продольным и внутренним - циркулярным. Слизистая оболочка покрыта многослойным (20 - 25 слоев) плоским эпителием. Длина пищевода у взрослого составляет в среднем 25-26 см у женщин, 27- 29 см у мужчин. Расстояние от передних резцов до кардии желудка варьирует от 37 до 42 см. Принято выделять три отдела пищевода. Шейный отдел длиной 6-7см. начинается на уровне VII шейного позвонка позади перстневидного хряща гортани и продолжается между трахеей и позвоночником до уровня верхней апертуры грудной клетки. Справа и слева от пищевода располагаются доли щитовидной железы. Грудной отдел пищевода длиной 16-18см расположен в заднем средостении, вначале между трахеей и пищеводом, а ниже уровня бифуркации - между сердцем и аортой, которая отодвигает его немного влево. Брюшной отдел длиной 4-6 см расположен на уровне XI-XII грудных позвонков. В пищеводе имеются три анатомических сужения: глоточное, аортальное (на уровне IV грудного позвонка) и диафрагмальное. Кровоснабжение шейного и верхнегрудного отделов пищевода осуществляется ветвями нижней щитовидной артерии; грудного - веточками бронхиальных артерий и собственно пищеводными артериями, отходящими от аорты; абдоминальный отдел кровоснабжается ветвями левой желудочной и нижней диафрагмальной артерий. Венозный отток осуществляется через непарную и полунепарную вены.
Лимфатическая система пищевода Для адекватного применения комбинированного и комплексного лечения больных РП имеют значение особенности лимфатической системы, которая представлена сетью капилляров и сосудов, располагающихся в слизистом, подслизистом и мышечных слоях, а также в адвентиции. Наиболее развита подслизистая сеть лимфатических сосудов, где располагаются лимфатические коллекторы, идущие по всей длине пищевода, связывая лимфатические сети всех слоев пищевода. Следует подчеркнуть, что нередко отводящие лимфатические сосуды пищевода, минуя регионарные лимфатические узлы, непосредственно впадают в систему грудного протока или левые желудочные лимфатические узлы. Регионарными лимфатическими узлами пищевода, согласно классификации TNM, являются: для шейного отдела пищевода - шейные и надключичные; для грудного отдела пищевода - верхние и нижние околопищеводные, бифуркационные, медиастинальные, перигастральные (включая чревные).
Метастазирование РП РП обладает высоким метастатическим потенциалом, метастазирует лимфогенным, гематогенным и имплантационным путями. Основным путем метастазирования является лифогенный – при Т1 метастазы в регионарных лимфоузлах находят в 60% случаев, а при поражении адвентиции - в 90%. Следует отметить, что при применении иммуногистохимических методов исследования частота выявления метастазов в регионарных лимфоузлах возрастает еще на 15-17% за счет выявления микрометастазов. Независимо от локализации опухоли, в грудном отделе пищевода высока вероятность метастатического поражения лимфоузлов, расположенных в трех анатомических зонах: на шее, в средостении и ниже диафрагмы. При этом, так называемые, «прыгающие метастазы» выявляются в 20% случаев. Отдаленные метастазы чаще всего обнаруживаются в печени, легких, костях скелета.
КЛАССИФИКАЦИЯ РАКА ПИЩЕВОДА Гистологическая классификация опухолей пищевода Подавляющее число злокачественных опухолей пищевода представлено плоскоклеточным раком (60 - 90%). Аденокарцинома встречается значительно реже. Однако в последние годы в западных странах в связи с ростом частоты аденокарциномы отмечено изменение соотношения между этими двумя типами опухолей. Если 10-15 лет назад аденокарцинома составляла 5-25%, то сейчас она составляет до половины случаев рака пищевода. Так в США в 1975 г. плоскоклеточный рак составлял 75%, за последние годы частота возникновения аденокарциномы пищевода у белого населения возросла на 450%, и сейчас доля аденокарцином достигает 43%. Большинство авторов связывают эти изменения с повышением частоты заболеваемости пищеводом Барретта, что, в свою очередь, обусловлено распространением ожирения и рефлюкс-эзофагита.
Классификация РП по TNM (7-я редакция, 2010г.)
Т – первичная опухоль Тх - недостаточно данных для оценки первичной опухоли Т0 - первичная опухоль не определяется Тis - интраэпителиальная опухоль без инвазии базальной мембраны Т1 – Т3 - опухоль инфильтрирует слизистую и подслизистую; мышечную оболочку; адвентицию Т4а-б - резектабельная опухоль с распространеняющаяся на плевру, перикард, диафрагму; нерезектабильная опухоль N – регионарные лимфатические узлы Nх – недостаточно данных для оценки состояния регионарных лимфоузлов N0 – нет признаков метастатического поражения регионарных лимфоузлов N1-3 – имеется поражение 1-2, 3-6, 7 и более регионарных лимфоузлов М – отдаленные метастазы Мх - недостаточно данных для определения отдаленных метастазов М0 - нет признаков отдаленных метастазов М1 - имеются отдаленные метастазы pTNM - патогистологическая классификация Все категории соответствуют требованиям, предьявляемым к TNМ, гистологическое исследование лимфоузлов средостения включает не менее 6 лимфоузлов. G - гистопатологическая дифференцировка Gx - степень дифференцировки не может быть установлена G1- высокая, G2 – средняя, G3 – низкая, G4 - недифференцированные опухоли R - резидуальная опухоль Rx - недостаточно данных для определения резидуальной опухоли R0 - резидуальной опухоли нет R1 - определяется микроскопически, R2 - определяется макроскопически. В последней редакции TNM введены понятия о сторожевом лимфоузле. Диагностика состояния сторожевых узлов проводится с помощью радиоизотопов или окрашивания водорастворимыми красителями. pN(sn) - сторожевой лимфоузел pNX(sn) - оценить сторожевой лимфоузел невозможно рN0(sn) - сторожевой лимфоузел не поражен рN1(sn) - сторожевой лимфоузел поражен
Классификация плоскоклеточного РП по стадиям
Классификация аденокарциномы пищевода по стадиям
Для грудного отдела пищевода шейные лимфоузлы не являются регионарными и обозначаются М1а. Для шейного отдела пищевода регионарными считаются только шейные лимфоузлы N1
Следует отметить, что частота выявления, так называемых «прыгающих метастазов» (метастазы в следующий этап метастазирования, минуя предыдущий) достаточно высока и достигает 10-15%.
3.8. КЛИНИКА РАКА ПИЩЕВОДА Симптомы РП на различных стадиях его развития очень разнообразны. Их общая характеристика облегчается при разделении на три основные группы. 1. Симптомы непосредственного поражения пищевода: дисфагия; повышенная саливация; боли при глотании, особенно твердой и вязкой пищи; ощущение неопределенного «царапания» за грудиной; запах изо рта; неприятный привкус во рту; тошнота, отрыжка, регургитация (срыгивание,«пищеводная рвота»).
2. Симптомы, характерные для заболеваний органов грудной полости: тупые боли в груди или спине; одышка и тахикардия после еды; тупые боли в области сердца и стенокардия без изменений электрокардиограммы; изменение тембра голоса; «беспричинные» приступы кашля; набухание одной из надключечных ямок. 3. С имптомы общие: адинамия, понижение работоспособности, быстрая утомляемость от привычной работы; понижение примитивных эмоций (в некоторых случаях, до выраженного безразличия), беспричинная раздражительность; похудание; «беспричинный» субфебрилитет; высокий процент гемоглобина крови, или, наоборот, анемия; гипопротеинемия,нарушение соотношений белковых фракций сыворотки крови. В ранних стадиях, когда небольшая опухоль размерами в несколько миллиметров локализуется в пределах слизистой, какие-либо специфические симптомы заболевания отсутствуют и её можно диагностировать только с помощью целенаправленного эндоскопического исследования. По различным оценкам, длительность доклинического периода при РП может достигать 1-2 лет. Ведущим симптомом рака пищевода является дисфагия, которую следует понимать как нарушения прохождения пищи по пищеводу различной степени выраженности. Дисфагия возникает относительно рано, но больные, среди которых преобладают употребляющие алкоголь и курящие мужчины, зачастую не придают значения эпизодическим проявлениям заболевания, поэтому от появления жалоб до момента обращения к врачу проходит в среднем 2-4 месяца. Ранние и малые формы рака, располагаясь в пределах слизисто-подслизистого слоя, сами по себе не создают препятствия для прохождения пищи. Вместе с тем они являются раздражителем, хотя и слабым, не всегда достаточным для возникновения эзофагоспазма. При волнении, приеме спиртных напитков, специй - слабый раздражитель, вызываемый патологическим очагом, может быть усилен, в результате чего возникает эпизодический спазм - функциональная фаза дисфагии при РП. По мере роста опухоли, когда она поражает около 2/3 окружности стенки органа и суживает его просвет на 50-75%, наступает органическая фаза дисфагии. Различают следующие степени выраженности дисфагии (по А.И.Савицкому): 1 степень - затрудненное прохождение по пищеводу грубой пищи (хлеб, мясо); 2 степень - затрудненное прохождение полужидкой пищи (супы, каши); 3 степень - затрудненное прохождение жидкой пищи (вода, сок и т.д.); 4 степень - полное отсутствие проходимости пищи по пищеводу.
Для РП характерно быстрое нарастание интенсивности симптома дисфагии в отличие от нарушений при доброкачественных опухолях пищевода. Гиперсаливация и регургитация также появляются при выраженном стенозе и являются одним из признаков затруднения прохождения пищи и усиления секреции слизистых желез стенки пищевода, независимо от того, каким патологическим процессом оно вызвано. Боли при раке пищевода встречаются достаточно часто, они тупые, неопределенные, ноющие, иногда «скребущие», напоминающие стенокардию (но без изменений на ЭКГ). Боли могут наблюдаться вне связи с дисфагией или сопровождают последнюю, возникая во время проглатывания пищи. Появление болей при глотании (одинофагия), иррадиирующих в спину, часто свидетельствует об изьязвлении опухоли, в то время как боли за грудиной, не связанные с глотанием, характерны для распространения опухоли на средостение и диафрагму. Как правило, боли свидетельствуют о местнораспространенном опухолевом процессе. Наличие общих симптомов, выраженных в различной степени, имеет место более чем у половины больных ракомпищевода. Потеря веса связана, главным образом, с вынужденным уменьшением количества принимаемой пищи и жидкости вследствие дисфагии и прогрессирует по мере ее нарастания. Однако в ряде случаев отмечается выраженная потеря массы тела без существенных нарушений проходимости пищевода, что указывает на метаболические нарушения. Появление бронхопульмональных жалоб: кашель, выделение мокроты (гнойной, с примесью пищи и т.д.), кровохарканье, осиплость голоса - свидетельствует о распространении опухоли на трахеобронхиальное дерево и легкие; поражении медиастинальных лимфоузлов и возможном образовании пищеводно-бронхиального свища, для которого характерны приступы сильного кашля во время приема пищи или жидкости. Постоянный или перемежающийся субфебрилитет, а иногда гектическая лихорадка, наблюдается вследствие некроза и инфицирования опухоли, сопровождающихся всасыванием продуктов ее распада. Температурная реакция у этих больных с трудом корригируется жаропонижающими средствами и антибиотиками. Анемия при РП развивается вследствие распада или изъязвления опухоли и иногда долгое время может быть единственным симптомом заболевания, сопровождаясь слабостью, апатией, снижением работоспособности и другими характерными симптомами. При этом, в анамнезе с помощью целенаправленного опроса, можно выявить эпизоды мелены (дегтеобразный черный жидкий стул) или оформленного черного кала. К достоверным признакам распространенного РП при наличии соответствующей клинической картины следует отнести увеличение лимфоузлов в надключичных областях, чаще слева (вирховский метастаз) и шейных лимфоузлов. Клиническая картина при различных локализациях РП имеет свои особенности.
ДИАГНОСТИКА РАКА ПИЩЕВОДА
Диагностика РП должна быть комплексной и основываться на данных клинических, инструментальных и морфологических методов. Принято различать первичную диагностику, направленную на выявление опухоли, и уточняющую диагностику - с целью определения распространенности процесса: 1) установление наличия внутри- или внепищеводного заболевания, суживающего его просвет; 2) дифференцировка РП от доброкачественных новообразований и других заболеваний пищевода; 3) установление точной локализации опухоли и ее распространенности по протяжению и по степени поражения стенок пищевода (сторона поражения, циркулярное расположение и т.д.); 4) степень и протяженность сужения пищевода, а также расширение его над местом сужения; 5) выяснение состояния околопищеводной клетчатки, лимфатических узлов средостения, проращение опухоли в соседние органы (легкие, бронхи, аорту, перикард, диафрагму); 6) стадирование опухолевого процесса и решение вопроса о возможности радикальной операции или необходимости другого вида лечения. Эти задачи могут быть решены только с помощью всего комплекса современных диагностических методов: рентгенологического исследования (рис 3.5), эзофагоскопии, КТ и методов цитологической и гистологической диагностики.
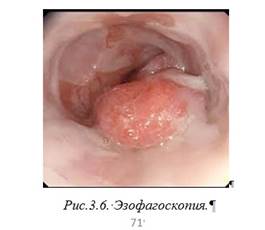
Алгоритм диагностики РП Первичная диагностика: жалобы (дисфагия, боли, саливация), анамнез; контрастная рентгенография пищевода (характер, локализация и протяженность процесса); эзофагоскопия (рис 3.6) (хромоэзофагоскопия), биопсия (морфологическая верификация).
Уточняющая диагностика: эндоУЗИ, компьютерная томография средостения (уточнение глубины инвазии и местной распространенности процесса); компьютерная томография брюшной полости, лапароскопия (выявление отдаленных метастазов).
Дифференциальная диагностика РП При дифференциальной диагностике РП в ранних стадиях необходимо иметь в виду ряд патологических процессов, сопровождающихся сходной клинической картиной: неспецифические воспалительные процессы (катаральный, язвенный и рубцево-язвенный эзофагит), рубцовые сужения пищевода, спазмы пищевода, доброкачественные опухоли (полипы, аденомы, фибромы, нейрофибромы, миомы, лейомиомы), язвенные процессы пищевода (пептическая язва, туберкулез, сифилис, актиномикоз), дивертикулы, ретенционные кисты, пристеночно расположенные инородные тела пищевода и т.д. Среди заболеваний заднего средостения, вызывающих сужение просвета пищевода и тем самым симулирующих рак, необходимо отметить следующие: аневризма аорты, опухоли заднего средостения, пакеты бронхиальных лимфатических узлов при туберкулезе и лимфогранулематозе, аномалии отхождения сосудов (двойная дуга аорты и др.). Для дифференциальной диагностики применяются все упомянутые выше диагностические методы, из которых основным и завершающим является морфологическое подтверждение диагноза. ЛЕЧЕНИЕ РАКА ПИЩЕВОДА Хирургическое лечение РП Основным в лечении РП является хирургический метод, однако в связи с крайне низкой ранней выявляемостью заболевания, только у 10-16% больных возможно хирургическое и комбинированное лечение. Применяются два вида хирургических вмешательств: радикальные операции и паллиативные (симптоматические). Цель радикальной операции - полное удаление основной опухоли и регионарных метастазов. Паллиативные операции направлены на предупреждение или разрешение осложнений опухолевого процесса и временное улучшение качества жизни больных. Основные требования, предъявляемые к радикальным операциям: обеспечение необходимого радикализма за счет удаления основной опухоли и регионарных лимфоколлекторов; обеспечение надежности операции путем применения совершенных хирургических методик; хирургическая профилактика функциональных осложнений и обеспечение качества жизни больных. В настоящее время при РП предпочтение отдается одномоментным хирургическим вмешательствам с двух или трехзональной лимфодиссекцией: · субтотальная эзофагэктомия из раздельного абдоминального и правостороннего трансторакального доступов с внутриторакальной пластикой желудочным стеблем (операция типа Льюиса); · тотальная трансторакальная эзофагэктомия с пищеводно-желудочным анастомозом на шее; · трансхиатальная эзофагэктомия абдоминомедиастинальным доступом с пищеводно-желудочным анастомозом на шее; · субтотальная эзофагэктомия из косого левостороннего абдомино-торакального доступа с внутриторакальной пластикой желудочным стеблем (операция типа Гарлока). Обьем радикального хирургического вмешательства определяется локализацией и распространенностью опухолевого процесса. При опухолях средне- и нижнегрудного отделов пищевода в большинстве случаев применяется одномоментная правосторонняя торакоабдоминальная субтотальная резекция пищевода с внутриплевральным анастомозом между желудочным трансплантатом и пищеводом (операция Льюиса). Стандартная операция Льюиса начинается с лапаротомии, ревизии брюшной полости с целью выявления лимфогенных (паракардиальные и забрюшинные лимфоузлы) или гематогенных (печень) метастазов, мобилизации желудка с выполнением лимфодиссекции, формирования желудочного трансплантата, диафрагмотомии, пилоротомии. Затем выполняется правосторонняя боковая торакотомия в 5-6 межреберье, широкая медиастинотомия, мобилизация пищевода на 5 см выше видимого края опухоли, медиастинальная лимфодиссекция, резекция пищевода, формирование пищеводно-желудочного анастомоза. Пластика пищевода чаще всего выполняется желудочным трансплантатом, сформированным из большой кривизны желудка, расположенным в заднем средостении. При невозможности использования желудка для пластики можно использовать толстую или тонкую кишку. При опухолях верхнегрудного отдела пищевода необходима одномоментная тотальная экстирпация пищевода торако-абдомино-цервикальным доступом, с пластикой пищевода и анастомозом на шее. При раке нижнегрудного отдела пищевода стандартной является одномоментная резекция нижней трети пищевода и проксимального отдела желудка с малым сальником из левостороннего торакоабдоминального доступа с формированием внутригрудного пищеводно-желудочного анастомоза (операция Гарлока). Показатели выживаемости при РП прямо зависят от наличия или отсутствия лимфогенных метастазов: при N0 5-летняя выживаемость достигает 55%, при N+ - 15%. Поэтому в хирургии пищевода особая роль отводится лимфодиссекции. Оценивая прогностическое значение лимфогенных метастазов, доказано, что если количество метастазов в регионарных лимфоузлах превышает «критическое число» - 7, то прогноз следует считать неблагоприятным. Классификация международного общества по болезням пищевода (ISDE) выделяет три уровня лимфодиссекции: стандартная - без удаления лимфоузлов верхнего средостения; расширенная - с удалением лимфоузлов верхнего средостения справа (2S); тотальная - с удалением лимфоузлов верхнего средостения с обеих сторон (2F). Летальность после хирургического лечения РП зависит от типа выполненной операции. При резекции или экстирпации пищевода она колеблется в пределах от 3-15%, при одномоментных операциях – 5-7%. Основными причинами летальных исходов являются сердечно-сосудистая недостаточность, пневмония и гнойные осложнения. Пятилетняя выживаемость больных после хирургического лечения не превышает 20-35% и прямо зависит от стадии заболевания.
Лучевая терапия в лечении РП Лучевая терапия, в плане комбинированного лечения, при операбельном раке пищевода применяется в виде предоперационных (неоадьювантная) или послеоперационных (адьювантная) курсов облучения. Как основной метод лечения лучевая терапия используется при неоперабельных опухолях в комплексе с полихимиотерапией. Предоперационная лучевая терапия направлена на девитализацию опухолевых клеток и уменьшение размеров опухоли. Применение предоперационной лучевой терапии основано на том факте, что под действием гамма-излучения в первую очередь погибают наиболее чувствительные периферические клетки опухоли. В результате опухоль уменьшается в размерах, снижается митотическая активность раковых клеток и снимается перифокальное воспаление. Таким образом, создаются благоприятные условия для хирургического лечения: увеличивается резектабельность опухоли и одновременно снижается угроза местной диссеминации опухолевых клеток. Современнную лучевую терапию РП проводят с помощью гамма- терапевтических аппаратов с источником Со60, линейных ускорителей, генерирующих высокоэнергетическое тормозное и электронное излучение (от 2 до 42 Мев). В настоящее время могут быть рекомендованы следующие варианты предоперационной лучевой терапии: 1. Методика укрупненного фракционирования дозы интенсивным ритмом по 4 Гр 5 раз в неделю, суммарной очаговой дозой 20 Гр. Операцию выполняют на 3-5-е сутки после окончания лечения. Указанная методика лучевой терапии показана при экзофитном характере роста опухоли у больных раком пищевода III стадии, протяженностью поражения не более 5-6 см, общем удовлетворительном состоянии больного в возрасте не старше 60 лет. 2. М етодика классического фракционирования дозы по 2 Гр 5 раз в неделю до суммарной очаговой дозы 40-46 Гр. 3. М етодика динамического фракционирования дозы по 4 Гр в течение 3 дней, затем по 2 Гр ежедневно до суммарной очаговой дозы 36-42 Гр. По биологическому эффекту эта доза эквивалентна 40-46 Гр при фракционировании 2 Гр в день. После завершения предоперационной лучевой терапии проводят клиническую, рентгенологическую и эндоскопическую оценку ее эффективности. Однако качественная оценка проведенной лучевой терапии - определение степени лучевого повреждения опухоли возможна лишь после выполнения хирургического этапа комбинированного лечения. Анализ отдаленных результатов показывает, что комбинированное хирургическое лечение с предоперационной лучевой терапией приводит к их улучшению во все сроки наблюдения. Предоперационная лучевая терапия не приводит к увеличению числа послеоперационных осложнений и летальности по сравнению с применением только хирургического метода. Когда операция расценена как паллиативная, но нет остаточной опухоли в средостении, проведение послеоперационной лучевой терапии наиболее целесообразно в режиме классического фракционирования или суперфракционирования дозы. В объем облучения входят ложе пищевода, области шейно-надключичных и паракардиальных лимфатических коллекторов (на ложе пищевода - до 50Гр, на зоны регионарного метастазирования - 40- 46Гр). При наличии удаленных в ходе операции метастазов в верхние перигастральные лимфатические коллекторы, эту зону подвергают облучению в дозе до 40-50 Гр.
Химиотерапия в лечении РП Лекарственное лечение больных РП является мультидисциплинарным методом терапии, при монотерапии 5-фторурацилом, цисплатином и паклитакселом частота достижения лечебного эффекта (полный + частичный регресс опухоли) достигает 20%, что свидетельствует о чувствительности РП к химиопрепаратам и необходмости применять комбинированное лечение. При использовании указанных препаратов в схемах (цисплатин + 5-фторурацил, цисплатин + паклитаксел, цисплатин + иринотекан, схемы с применением оксалиплатина, эпирубицина, каперубицина, этопозида, митомицина-С, винорельбина) возможно достижение лечебного эффекта у 44-55% больных, независимо от гистологической формы опухоли (аденокарцинома или плоскоклеточный рак). ПХТ в настоящее время применяется и в виде периоперационного лечения. Лекарственное лечение при раке пищевода может использоваться в следующих случаях: · с целью повышения эффективности лучевой терапии (радиосенсибилизация); · с неоадъювантной целью (при операбельном раке перед хирургическим лечением); · с адъювантной целью (после радикального хирургического вмешательства при местнораспространенном раке); · с паллиативной целью при местнораспространенных и метастатических формах. Основной причиной ограниченного использования химиотерапии являются такие противопоказания как, ослабленное общее состояние и кахексия у значительной части больных.
Химиолучевое лечение РП В средине 70-х годов рядом авторов (I.Wodinsky и соавт. 1974 г) был показан радиосенсибилизирующий эффект, обусловленный взаимодействием препаратов платины с ДНК с образованием поперечных связей. Поэтому в ряде стран неоадьювантная радиохимиотерапия в комбинированном лечении рака пищевода считается на сегодняшний день стандартным методом лечения, несмотря на то, что дает эффект не более чем у 50% больных. В связи с этим у больных с местнораспространенными формами рака пищевода целесообразно комплексное лечение с лучевой терапией и 3-5 курсами адъювантной полихимиотерапии препаратами платины, циклофосфаном, этопозидом и другими препаратами, показавшими эффективность при РП. При распространенном опухолевом процессе полихимиотерапия, в ряде случаев, дает возможность временно улучшить качество жизни больных и избежать симптоматических операций, поэтому ее применение, при отсутствии противопоказаний, вполне оправдано.
Паллиативная терапия РП Большинство больных раком пищевода (70-85%) к моменту поступления на лечение являются неоперабельными из-за распространения опухолевого процесса, серьезных сопутствующих заболеваний или ослабленного состояния, обусловленного стенозом пищевода, приводящим к дисфагии и различным нарушениям питания. Кроме того, местные рецидивы опухоли в зоне анастомоза с полной или частичной обструкцией просвета органа развиваются даже после радикальных операции у 20% больных. Поэтому паллиативные методы являются необходимыми в лечении больных со стенозирующим раком пищевода. Главной задачей паллиативного лечения является улучшение качества жизни больных и, по возможности, ее продление за счет восстановления естественного питания.
Прогноз и отдаленные результаты лечения РП Прогноз при РП нельзя считать удовлетворительным, разброс показателей 5-летней выживаемости колеблется в пределах от 4% до 14%. При хирургическом лечении в среднем 5-летний срок переживают 25-35% оперированных. У перенесших радикальные операции этот показатель составляет 45-50%, у перенесших паллиативные операции - до 5%. В случае только хирургического лечения наличие регионарных метастазов снижает показатель 5-летней выживаемости до единичных наблюдений. При комбинированном лечении подобная закономерность сохраняется: 5 лет наблюдения переживают около 35-40% больных, в том числе 55-60 % пациентов после радикальных операций и только 7% - после паллиативных. При комплексном лечении после радикальных операций более 5 лет живут 55-60% больных, после паллиативных операций выживаемость достигает 30%. Нелеченый РП всегда имеет плохой прогноз. Больные с нерезектабельной опухолью обычно погибают в течение года. Средняя продолжительность жизни таких больных не превышает 5-8 месяцев с момента появления признаков болезни. Прогноз заболевания при лучевой терапии зависит от формы роста опухоли. Наихудшими являются результаты при эндофитной форме роста. Трехлетняя выживаемость в этой группе составляет 6,0%, тогда как при экзофитном росте она достигает 27%. Применение лучевой терапии по паллиативной программе позволяет 7-10% больных прожить более года. По- видимому, возможности лучвой терапии еще далеко не исчерпаны
Интерактивное занятие "Рак пищевода и желудка" ×Вы должны завершить лекцию за 20 мин.. Анатомия желудка Кровоснабжение желудка осуществляется левой и правой желудочными артериями, левой и правой желудочно-сальниковыми артериями, а также короткими желудочными артериями.
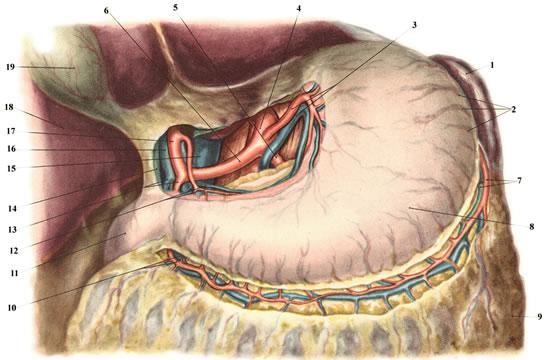
Кровоснабжение желудка. Малый сальник и париетальная брюшина сальниковой сумки частично иссечены. 1 — lien; 2 — aa. et vv. gastricae breves; 3 — a. et v. gastrica sinistra; 4 — truncus coeliacus; 5 — a. lienalis; 6 — a. hepatica communis; 7 — a. et v. gastro-epiploica sinistra; 8 — ventriculus; 9 — omentum majus; 10 — a. et v. gastro-epiploica dextra; 11 — duodenum; 12 — a. et v. gastrica dextra; 13 — a. et v. gastroduodenalis; 14 — ductus choledochus; 15 — v. cava inferior; 16 — v. portae; 17 — a. hepatica propria; 18 — hepar; 19 — vesica fellea.
Рис. 168. Лимфатические сосуды и узлы желудка, печени и почки. 1 - правые желудочные лимфатические узлы (nodi lymphatici gastrisi dextri); 2 - чревный лимфатический узел (nodus lymphaticus coeliacus); 3 - левые желудочные лимфатические узлы (nodi lymphatici gastrici sinistri); 4 - селезеночные лимфатические узлы (nody lymphatici splenici); 5 - лимфатические сосуды передней стенки желудка; 6 - правые желудочно-сальниковые лимфатические узлы (nodi lymphatici gastro-omentales dextri); 7 - поясничные лимфатические узлы (nodi lymphatici lumbales); 8 - лимфатические сосуды почки и надпочечника; 9 - лимфатические сосуды нижней поверхности печени От желудка (см рис. 168) лимфа оттекает в правые и левые желудочные узлы (у малой кривизны желудка), кардиальные (лимфатическое кольцо кардии), левые и правые желудочно-сальниковые (у большой кривизны желудка), панкреатические и селезеночные (в воротах селезенки), пилорические (по ходу желудочно-двенадцатиперстно-кишечной артерии), печеночные (вдоль печеночных сосудов). Классификация рака желудка
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-04-04; просмотров: 100; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.222.138.230 (0.072 с.) |