
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Определение рефракции и структурной формулы вещества
Цель работы: изучение метода определения структурной формулы вещества известного состава; установление формулы исследуемого вещества. Задание: 1. Определить плотность и показатель преломления исследуемого вещества; 2. Рассчитать опытную молярную рефракцию R М оп; 3. Записать возможные изомеры вещества известного состава; 4. Рассчитать теоретическую R М теор для всех возможных структурных формул данного эмпирического состава; 5. Сопоставлением R М оп и R М теор установить структурную формулу исследуемого вещества. Рассчитать ошибку эксперимента. Молярная рефракция R М оп может быть рассчитана по уравнению (1.10), из которого следует, что предварительно необходимо определить показатель преломления и плотность исследуемого вещества. Обе величины должны определяться при одной и той же температуре.
Порядок проведения работы
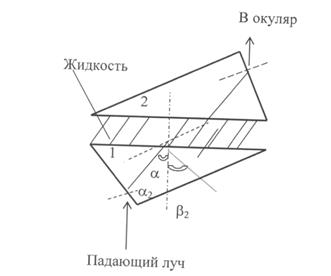
Определение показателя преломления вещества. Для определения показателя преломления вещества используется прибор рефрактометр. действие рефрактометра основано на явлении полного внутреннего отражения луча света при прохождении его через ту или иную среду. Основной частью рефрактометра являются две прямоугольные призмы 1 и 2 на рисунке 1.1, выполненные из специального стекла и притертые по диагональным плоскостям. Между призмами помещается капля исследуемой жидкости, которая растекается по поверхностям тонким слоем. С помощью зеркала направляют луч света на грань призмы 1. Луч света проходит через призму 1, затем через тонкий слой исследуемой жидкости, потом через призму 2 и, выходя наружу, попадает в компенсатор, а оттуда – в окуляр. При пользовании дневным светом часть лучей, падающих на границу стекло-жидкость под углом a, меньшим предельного, пройдет через жидкость, призму 2 и окуляр. Часть лучей, падающих под углом a 2, большим предельного, не пройдет в жидкость, а отразится внутри призмы 1 на основании принципа полного внутреннего отражения (угол b 2). Поэтому, меняя положение окуляра, можно видеть либо светлое, либо темное поле, или, наконец, одну половину поля светлую, а другую – темную. Положение границы раздела соответствует углу полного внутреннего отражения и связано с показателем преломления исследуемой жидкости. В окуляре рефрактометра имеется визирная линия в виде трех черточек. Путем изменения положения окуляра нужно добиться, чтобы визирная линия совпала с границей раздела светлого и темного полей, которая должна быть четкой. Показатель преломления определяется с точностью до четвертого знака после запятой.
Капля жидкости наносится на поверхность призмы пипеткой. Так как жидкость летуча, то измерение нужно делать быстро. После того, как измерение произведено, аккуратно вытирают поверхность призмы фильтровальной бумагой. Рисунок 1.1 – Схема рефрактометра
Определение плотности жидкости. Сухой и чистый пикнометр с пробкой взвешивают сначала на технических весах, затем на аналитических весах. Наливают в него дистиллированную воду и устанавливают нижний мениск жидкости точно по метке. Пикнометр с водой взвешивают на технических, затем на аналитических весах. Затем воду выливают, пикнометр высушивают и наливают в него исследуемую жидкость, доводят жидкость в пикнометре до метки и проводят взвешивания. Записывают в рабочую тетрадь массу пустого пикнометра m о, массу пикнометра с водой m 1 и массу пикнометра с исследуемой жидкостью m 2.
Для нахождения истинной плотности нужно внести поправку на взвешивание в воздухе. Каждое тело, погруженное в воздух, теряет в своей массе столько, сколько весит вытесненный им воздух. Такое влияние оказывает воздух, как на взвешиваемое тело, так и на уравновешивающие его гирьки. Если бы объемы тела и гирек были одинаковы, то влияние воздуха было бы тоже одинаково и при равных массах весы были бы в равновесии. Однако плотность гирек больше, чем тела, и тело вытесняет больше воздуха, чем гирьки; следовательно, на воздухе тело может быть уравновешено меньшей массой гирек. Чтобы найти истинную массу тела, надо в кажущуюся массу тела, полученную при взвешивании на воздухе (m о, m 1, m 2), внести поправку на массу воздуха, соответствующую разнице объемов тела и гирек.
Расчет плотности жидкости ведется по уравнению:
где r возд – плотность воздуха (r возд = 0,0012 г/см3). Для расчета используют результаты взвешивания масс на аналитических весах. Плотность воды r Н 2 О при температуре взвешивания находят в справочнике. Эмпирическую формулу вещества получают у преподавателя. На основании полученных значений n и r по формуле (1.10) рассчитывают величину опытной молярной рефракции R М оп. Составляют и заносят в лабораторный журнал все возможные изомеры соединения данного состава. Из справочника выписывают в лабораторный журнал значения атомных рефракций для атомов, составляющих молекулу вещества. По правилу аддитивности рассчитывают теоретические молярные рефракции R М теор для каждого из возможных изомеров: Полученные в работе данные должны быть представлены в виде табл.1.1.
Таблица 1.1 – Данные для установления структурной формулы вещества
Сопоставляют опытное и теоретические значения R М. Выбирают структурную формулу, для которой R М теор наиболее близко к R М оп. Относительную погрешность определения R М рассчитывают по формуле Δотн. = (R Моп – R Мтеор) . 100 / R Мтеор, %. (1.13) Сделайте выводы по проделанной работе.
Контрольные вопросы 1. Понятия: дипольный момент, поляризация, поляризуемость. 2. Из чего складывается поляризация полярных и неполярных молекул? 3. Поляризация деформации. От чего зависит индуцированный дипольный момент? 4. Поляризация ориентации, зависимость ее от температуры. 5. Уравнение Дебая. Смысл входящих в него величин. 6. Молярная рефракция. 7. Последовательность установления структурной формулы вещества. Термохимия
Термохимия – раздел химической термодинамики, который изучает тепловые эффекты химических реакций, теплоты фазовых переходов, теплоты растворения веществ, разбавления растворов и т.п. Выделение или поглощение теплоты в результате химического превращения или физико-химического процесса есть следствие того, что суммарная энергия веществ в конце процесса отличается от суммарной энергии веществ в исходном состоянии. Экспериментально (калориметрически) измеряемая теплота химического превращения зависит от количеств реагентов и условий проведения опыта. Тепловым эффектом химической реакции называют количество теплоты, которое выделяется или поглощается в результате реакции, при условиях: 1)процесс протекает необратимо при постоянном объеме или давлении; 2) во время реакции не совершается других видов (полезной) работы, кроме работы расширения; 3) исходные вещества и продукты реакции имеют одинаковую температуру. В основе изучения термохимических процессов лежит первый закон термодинамики, который для бесконечно малых элементарных процессов имеет следующий вид:
или где δ Q – тепло, сообщенное системе; dU – изменение внутренней энергии системы; δ A – работа, совершаемая системой против внешних сил; P – давление, при котором совершается процесс; dV – изменение объема системы. Если тепло сообщено системе при неизменном объеме (V = const, dV = 0, изохорный процесс), то работа против внешнего давления отсутствует и тепловой эффект реакции Следовательно, при V = const вся теплота, подведенная к системе, расходуется на увеличение ее внутренней энергии. Если тепло сообщено системе при постоянном внешнем давлении (P = const, изобарный процесс), то тепловой эффект реакции
где изменение энтальпии системы Следовательно, в изобарном процессе теплота, переданная системе, расходуется на увеличение внутренней энергии ( Δ U) P и на совершение работы против внешнего давления. При этом теплота изобарного процесса равна приращению энтальпии системы во время этого процесса. В качестве основной единицы измерения теплоты в системе СИ установлен джоуль (Дж). Для описания тепловых явлений в химических реакциях принято пользоваться термохимическими уравнениями. Термохимические уравнения записываются с указанием физического состояния вещества: газообразное (г), жидкое (ж), кристаллическое (к) или раствор (р-р); с указанием аллотропной (полиморфной) модификации, а также величины и знака теплового эффекта химической реакции. В случае экзотермических реакций в правой части уравнения записывают количество выделившейся теплоты со знаком «плюс», в случае эндотермических реакций – количество поглощенной теплоты со знаком «минус». Если в уравнении химической реакции указывается не тепловой эффект, а изменение ее энтальпии Например: Са(к) + С(гр) + З/2O2 =СаСОз(к) + 1206,8кДж или Са(к) + С(гр) + З/2O2 =СаСОз(к),
основным законом термохимии является закон Гесса: если из данных исходных веществ можно получить заданные конечные вещества различными путями, то суммарная теплота на одном каком-нибудь пути равна суммарной теплоте процесса на любом другом пути. Таким образом, тепловой эффект химических реакций не зависит от пути перехода, а определяется только начальным и конечным состояниями системы.
Закон Гесса незаменим для расчета тех тепловых эффектов, которые нельзя измерить калориметрически. Например, теплоту образования СО (D Н) при реакции С + О2 вследствие течения реакции как с образованием СО, так и СО2 экспериментально определить невозможно. Однако с помощью закона Гесса с использованием легко определяемых калориметрически тепловых эффектов реакций D Н 1, и D Н 2 он может быть рассчитан: С + О2 = СО2, D Н 1 СО + 1/2О2 = СО2, D Н 2 С + 1/2О2 = СО, D Н D Н 1 = D Н + D Н 2 по закону Гесса D Н = D Н 1 – D Н 2 Закон Гесса применим и для определения тепловых эффектов, сопровождающих процессы растворения веществ, разбавления жидкостей. Он используется для расчета тепловых эффектов реакции по стандартным теплотам образования или сгорания веществ, расчета энергии химической связи. Реакции, при которых теплота поглощается (Δ U >0 и Δ H >0) называются эндотермическими, а реакции, протекающие с выделением теплоты (Δ U <0 и Δ H <0) – экзотермическими. Тепловой эффект считают: – положительным D Н > 0 (Q P < 0) для реакций, при которых теплота поглощается (эндотермические); – отрицательным D Н < 0 (Q P > 0), е сли реакция протекает с выделением теплоты (экзотермические). Тепловой эффект, сопровождающий процесс растворения вещества в жидкости называется теплотой растворения. Различают интегральную и дифференциальную теплоту растворения. Интегральной теплотой растворения называют тепловой эффект растворения 1 моля вещества в таком количестве растворителя, чтобы получился раствор концентрации С m. Дифференциальной теплотой растворения – тепловой эффект растворения 1 моля вещества в бесконечно большом количестве раствора концентрации С m. Дифференциальные теплоты определяются расчетным методом, а интегральные – экспериментально. Определение тепловых эффектов химических реакций и физико-химических процессов проводят в специальных приборах калориметрах. Следует различать два способа проведения калориметрического опыта. При одном из них температура пространства, окружающего калориметр, остается в течение всего опыта постоянной (калориметр с изотермической оболочкой). При другом – температура оболочки, окружающей калориметр, в течение опыта меняется так, чтобы в каждый момент времени она была равна температуре калориметра (калориметр с адиабатической оболочкой). Последний способ употребляется в том случае, если исследуемые процессы протекают очень медленно и возможна потеря части теплового эффекта процесса в результате теплообмена калориметра с окружающей средой. Любой калориметрический опыт сводится к определению изменения температуры калориметрической жидкости в результате проходящего в ней химического или физико-химического процесса. Тепловые эффекты рассчитывают, используя экспериментальные данные и известные значения теплоемкости.
Теплоемкостью называют количество теплоты, поглощаемой веществом при его нагревании на 1оС (1K). Различают удельную и молярную теплоемкости. Молярная теплоемкость – это количество теплоты, поглощаемой 1 моль вещества при нагревании его на 1оС. Истинную теплоемкость определяют как количество теплоты, поглощаемое при бесконечно малом изменении температуры С = d Q /d Т. В эксперименте определяют среднюю теплоемкость с = D Q / D Т. Если процессы происходят при постоянном давлении или объеме, то D Q Р = – D Н, а D Q V = – D U. Тогда:
С использованием калориметрических данных и приведенных формул рассчитывают значения теплоемкостей и тепловые эффекты химических реакций и физико-химических процессов.
|
|||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-03-09; просмотров: 159; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.118.45.162 (0.036 с.) |
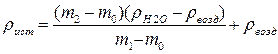 , (1.11)
, (1.11)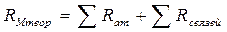 (1.12)
(1.12)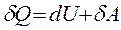 (2.1)
(2.1)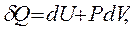 (2.2)
(2.2)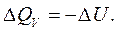 (2.3)
(2.3)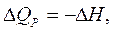 (2.4)
(2.4)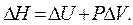
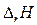 , оно записывается отдельно.
, оно записывается отдельно.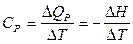 ;
; 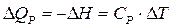 (2.5)
(2.5)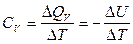 ;
; 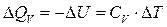 (2.6)
(2.6)


