Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Перегонка бинарных смесей полностью смешивающихся жидкостей ⇐ ПредыдущаяСтр 8 из 8
Цель работы: Освоение метода построения фазовых диаграмм «температура кипения – состав». Задание: 1. Определить температуру кипения жидких смесей различного состава. 2. Определить показатель преломления жидких смесей и конденсата. 2. Определить состав пара смесей разного состава. 3. Построить фазовую диаграмму в координатах «температура кипения – состав». Порядок выполнения работы Для построения фазовой диаграммы смеси двух растворителей в координатах температура кипения Т к – состав раствора (пара), необходимо, во-первых, определить температуру кипения чистых растворителей и их смесей разного состава, и во-вторых, определить состав пара по предварительно построенному градуировочному графику: показатель преломления п = f (состав смеси). 1. Приготовление смесей растворителей. Готовят 5 бинарных смесей объемом по 30 см3 в сухих колбах с притертыми пробками. При этом необходимо пользоваться цилиндрами, имеющими градуировку с абсолютной погрешностью до 0,1 см3. 2. Определение показателя преломления смесей растворителей. С помощью рефрактометра(см. лабораторную работу № 1) измеряют показатель преломления всех приготовленных смесей и исходных компонентов. На основании полученных данных строят градуировочный график в координатах: показатель преломления – состав смеси (рисунок 4.5). Состав смеси выражают в массовых долях, %
где X 2 – массовая доля компонента в смеси, %;
Рисунок 4.5 – Зависимость показателя преломления от состава смеси
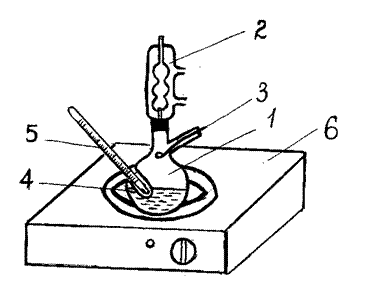
Отклонение калибровочной прямой от линейности свидетельствует о допущенных при приготовлении растворов ошибках и необходимости приготовления новых смесей. 3. Определение температуры кипения раствора и показателя преломления конденсата. Температуру кипения раствора или чистого компонента определяют на приборе, состоящем из круглодонной колбы 1 (рисунок 4.6), соединенной с обратным холодильником 2 и снабженной ложечкой 3 для сбора конденсата. Термометр 5 помещается в пробирку 4, впаянную в колбу.
При подготовке установки к работе, необходимо учесть следующее: 1) вогнутая сторона ложечки должна находиться под отростком холодильника, с которого стекает конденсат; 2) нижний конец термометра должен касаться дна пробирки, которое, в свою очередь, должно касаться поверхности нагреваемой жидкости или может быть на 0,5–1,0 см ниже ее уровня.
Рисунок 4.6 – Схема установки для перегонки
Эксперимент по определению температуры кипения желательно начинать с наиболее низкокипящего раствора. Для этого необходимо поместить весь приготовленный объем смеси жидкостей или 30 мл исходного компонента в сухую колбу 1, соединить колбу с обратным холодильником 2, вставить пробку с ложечкой 3 выпуклой стороной вверх, а термометр 5 в пробирку 4. Затем укрепить весь прибор в штативе над колбонагревателем 6. После того, как начнется кипение жидкости, температура установится постоянной (температура кипения раствора до отбора конденсата, которую нужно записать в таблицу), и будет происходить интенсивное образование конденсата, ложечку 3 поворачивают выпуклой стороной вниз и собирают в нее 3-4 капли конденсата. Отобранное количество конденсата во избежание его испарения быстро переносят на призму рефрактометра и определяют показатель преломления. Пробку с ложечкой быстро помещают обратно выпуклой стороной вверх и после отбора конденсата вновь измеряют температуру и записывают ее в таблицу. При условии, что все действия и определения проводились достаточно аккуратно и быстро, разность между температурами кипения до и после отбора конденсата будет находиться в пределах 1 °С. Оставшуюся жидкость выливают в склянку для слива, колбу высушивают и проводят аналогичные действия с другими смесями. Все данные записывают в таблицу 4.2. Значения показателя преломления конденсата используют для определения состава конденсата (пара) по градуировочному графику. 4. Построение диаграммы фазового равновесия: температура кипения - состав пара – состав жидкости (Р = const) На основании опытных данных строят фазовую диаграмму: температура кипения – состав раствора (пара). Для этого по оси ординат откладывают среднюю температуру кипения (если она несколько изменилась до и после отбора пробы). На оси абсцисс откладывают составы жидкости и пара (% масс). Каждой температуре (кроме чистых компонентов) будут соответствовать две точки, определяющие состав жидкости и состав равновесного с ней пара. Соединяя соответствующие точки, получают две кривые: 1) Ткип – состав жидкости (кривая жидкости) и 2) Ткип – состав пара (кривая пара).
На фазовой диаграмме необходимо отметить гомогенную и гетерогенную области.
Таблица 4.2 – Данные для построения фазовой диаграммы
Контрольные вопросы 1. Понятия: гомогенные и гетерогенные системы, фаза, компоненты, фазовые превращения, число степеней свободы. 2. Правило фаз Гиббса и его применение. 3. Диаграммы фазовых состояний. 4. Области существования фаз на диаграммах кипения. 5. Определение составов равновесных фаз на диаграммах кипения. 6. Применение правила рычага. 7. Законы Коновалова. 8. Свойства азеотропных систем. 9. Назначение перегонки, виды перегонки.
Литература 1. Стромберг А.Г., Семченко Д.П. Физическая химия. – М.: Высшая школа, 2006. – 527 с. 2. К.С. Краснов, Н.К. Воробьев, И.Н. Годнев и др. Физическая химия: В 2 кн. Учебник для вузов. /Под ред. К.С. Краснова. – М.: Высшая школа, 2001. – 512 с. 3. Горшков В.И., Кузнецов И.А. Основы физической химии. – М.; БИНОМ. Лаборатория знаний, 2010. – 407 с. 4. Киреев В.А. Краткий курс физической химии. – М.: Химия, 1978.– 620 с. 5. Краткий курс физической химии/Под ред. С.Н. Кондратьева. – М.: Высшая школа, 1978. – 312 с. 6. Практикум по физической химии/Г.С. Каретников, Н.А. Козырева, И.В. Кудряшов и др.; Под ред. И.В. Кудряшова. – М.: Высшая школа, 1986. – 495 с. 7. Краткий справочник физико-химических величин/Под ред. Равделя А.М., Пономаревой А.М. – СПб.: Химия, 2002. – 233 с.
Учебно-методическая литература
Кильдеева Наталия Рустемовна Гридина Наталья Николаевна
ФИЗИЧЕСКАЯ ХИМИЯ.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-03-09; просмотров: 171; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.137.185.180 (0.016 с.) |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
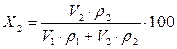 , (4.6)
, (4.6)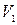 ,
, 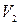 – объемы первого и второго компонентов смеси, мл;
– объемы первого и второго компонентов смеси, мл;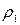 ,
, 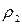 – плотности компонентов смеси, г/см3;
– плотности компонентов смеси, г/см3;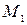 ,
, 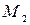 – молярные массы первого и второго компонентов, г/моль.
– молярные массы первого и второго компонентов, г/моль.