
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Обзор теорий растворов электролитов
Многие теории растворов электролитов представляют собой основные (классические) теории растворов неэлектролитов, адаптированные к растворам электролитов, с учетом специфики, связанной с диссоциацией электролитов на ионы. Это, прежде всего, химическая теория растворов Д.И. Менделеева. В основе теории Д.И. Менделеева акцент делается на принципиальные положения о химическом взаимодействии молекул растворителя и частиц растворенного вещества. Диссоциация растворяемого вещества либо отрицается, либо принимается незначительной. Это справедливо для растворов неэлектролитов, но нельзя признать корректным для растворов электролитов. Диаметрально противоположна теории растворов Д.И. Менделеева теория С. Аррениуса. Среди положений этой теории можно отметить следующие: · при растворении молекулы электролита частично распадаются (диссоциируют) на ионы – частицы, имеющие противоположные заряды; · в общем случае способность молекул электролита к диссоциации определяется степенью диссоциации (a); · при бесконечном разбавлении электролиты диссоциируют нацело; · раствор всегда электронейтрален; · между растворенными молекулами и ионами устанавливается термодинамическое равновесие, характеризуемое константой диссоциации (К дис), величину которой можно рассчитать по уравнению Оствальда (6.2а); · в разбавленном растворе молекулы растворенного вещества ведут себя подобно молекулам идеального газа. Растворитель является инертной средой. Существенным недостатком теории Аррениуса является то, что она не допускает возможности, каких бы то ни было взаимодействий компонентов раствора и вследствие этого не в состоянии объяснить механизмы растворения химических веществ[4]. Теория растворов Вант-Гоффа возникла как результат обработки опытных данных по исследованиям осмоса с учетом уравнения, которое представляет закон Вант-Гоффа (см. табл. 1.7). Эта теория сравнительно неплохо позволяет предсказывать значения осмотического давления в разбавленных растворах как неэлектролитов, так и электролитов. Современная теория растворов электролитов, по сути, объединила ранние теории и, принимая положение о диссоциации молекул растворенного вещества на ионы в основе большинства процессов в растворах электролитов, учитывает наличие взаимодействий в растворе как между растворителем и ионами растворяемого вещества (ионная сольватация [5]) так и между сольватированными ионами (ионная ассоциация).
Специфика равновесия в растворах слабых электролитов Диссоциация молекул электролита на ионы подчиняется известным законам химического равновесия, описанным в главе 4. Поэтому в растворах слабых электролитов устанавливается динамическое равновесие между молекулами электролита и ионами. Принципиальным моментом при анализе ионных равновесий в реальных растворах является необходимость всякий раз решать можно ли в конкретном случае в расчетах использовать аналитические концентрации вместо активностей. Ответ достаточно прост, если речь идет растворах слабых электролитов. Для них, как правило, использование при расчетах равновесий концентраций не приводит большим ошибкам, а концентрационные зависимости оказываются весьма значимыми. В общем случае равновесие в растворах слабых электролитов без учета сольватации можно представить схематично соотношением: MxAy = x M l + + y A m – (6.1) а также соответствующей константой равновесия (К с), называемой в этом случае концентрационной константой диссоциации (Кдис)
В частном случае 1,1 – валентного электролита МА, диссоциирующего в соответствии с уравнением MA = M + + A –, для раствора, аналитическая концентрация которого равна с о, константу диссоциации можно выразить уравнением Оствальда:
Из уравнения (6.2 а) следует, что чем больше Кдис, тем выше степень диссоциации. Поэтому величина Кдис может служить мерой силы электролита (способности его молекул) диссоциировать. Для умеренно слабых электролитов, например Н3РО4 (первая ступень), Са(ОН)2 значения К дис лежат в пределах от 10-2 до 10-4, для более слабых электролитов, например СН3СООН и NH4OH, величина К дис находится в пределах от 10-5 до 10-9. Если К дис<10-10 электролит относят к очень слабым [5].
Считается, что уравнение Оствальда[6] желательно применять при концентрациях электролита меньше 0,01 моль/л. Для описания равновесия в более концентрированных растворах оно не годится, и следует использовать термодинамические константы диссоциации К т, выраженные через активности компонентов:
В случае некоторых электролитов, когда a<<1 можно принять 1– a=1, тогда формула (6.2 а) упрощается и приобретает следующий вид: К дис = a2 с о. (6.3) Учитывая, что константа диссоциации - величина постоянная при данной температуре, на основании уравнения (6.3) можно заключить, что с уменьшением концентрации электролита (разбавлением раствора) степень диссоциации увеличивается. Важной характеристикой равновесия в растворах слабых электролитов является изотонический коэффициент (i) – величина, показывающая, во сколько раз увеличивается общее число частиц (ионов и молекул), в результате диссоциации. Его величину несложно связать со степенью диссоциации. При анализе соотношения (6.1) можно показать, что равновесные концентрации MxAy, x M l + и y A m – равны соответственно (1-a) с о, a x с о и a y с о. Отсюда следует, что:
Обозначая x + y через n, преобразуем соотношение (6.4) в известную формулу (1.6): i = 1 + (n- 1) a.
|
||||||
|
Последнее изменение этой страницы: 2020-12-17; просмотров: 144; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.141.47.221 (0.007 с.) |
 . (6.2)
. (6.2) . (6.2 а)
. (6.2 а) . (6.2 б)
. (6.2 б)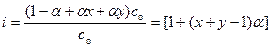 . (6.4)
. (6.4)


