
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Буферирование физико-химических
Характеристик растворов Под буферированием понимают поддерживание на заданном уровне тех или иных характеристик раствора. Такими характеристиками часто оказываются рН, концентрация ионов определенного вида, ионная сила и др. Буферирование выполняют, вводя в исследуемый раствор соответствующие буферные смеси или растворы отдельных солей в концентрациях достаточных для поддерживания на одном уровне выбранных характеристик. Буферная смесь (буфер) – смесь растворов веществ, часто электролитов, подобранных таким образом, чтобы можно было обеспечить при изменении состава среды постоянство заданных характеристик исследуемого раствора. С учетом задач исследователя состав буфера в каждом конкретном случае подбирается специально. Буфер рН. Буферные растворы для поддерживания заданных значений рН готовятся на основе сопряженных пар типа: слабая кислота - сильная соль этой кислоты и слабое основание – сильная соль этого основания. Буферирующее действие обусловлено тем, что добавляемые к буферу ионы водорода или гидроксида связываются компонентами буфера, не вызывая заметного смещения ионного равновесия в пределах некоторого достаточно узкого диапазона рН. Для различных буферных смесей диапазон буферирования, как правило, находится в пределах р К ±1 (р К - отрицательный логарифм константы диссоциации слабой кислоты или слабого основания). Меняя концентрации компонентов буфера, получают растворы с заданными значениями рН в пределах области буферирования. Исключение составляют универсальные буферные смеси с расширенными областями буферирования, в случае которых требуемые рН создаются добавками к основному составу буфера 0,2 М раствора NaOH. Составы некоторых буферных смесей приведены в табл. 6.3. Таблица 6.3 Составы и характеристики буферных смесей [34] Авторы |
Кислота |
Основание |
Интервал рН | ||||
| Состав | р К (при 298 К) | |||||||
| Двухкомпонентные смеси | ||||||||
| С.П.Серенсен | НCl | - | Глицин | 1,0 …3,7 | ||||
| Х.Т.С.Бриттон | Лимонная – C3H4OH(COOH)3 | pK (H4L)=3,1 pK (H3L-)=4,4 | NaOH | 2,2 … 6,5 | ||||
| Т.С.Макливен | Муравьиная - HCOOH | 3,8 | NaOH | 2,8 … 4,6 | ||||
| Х.Т.С.Бриттон - | Уксусная - CH3COOH | 4,76 | CH3COONa | 3,7 … 5,6 | ||||
| В.М. Кларк | KH2PO4 | 7,21 | NaOH | 5,8 … 8,0 | ||||
| В.М. Кларк | Борная - H3BO3 | 9,2 | NaOH | 8,0 … 10,0 | ||||
| С.П. Серенсен | Глицин (аминоуксусная) – H2NCH2COOH | pK (СООН)=2,34 pK (NН2)=9,6 | NaOH | 8,2 … 10,1 | ||||
| С.П. Серенсен | Глицин + Na2HPO4 | - | NaOH | 8,3 … 11,9 | ||||
| И.М. Кольтгофф | Na2B4O7 | - | Na2CO3 | 9,2 … 11,0 | ||||
| Универсальная буферная смесь
| ||||||||
| Х.Т.С. Бриттон –Р.А.Робинсон | 0,04 М раствор фосфорной, уксусной и борной кислот | 0,2 М NaOH | 1,8 … 11,9 | |||||
 Оценку рН буферных растворов выполняют на основе анализа ионных равновесий, характеризующих данный буфер. Например, для двухкомпонентной буферной смеси слабой кислоты НА и ее соли NaA ионные равновесия можно представить набором уравнений, включающих закон действующих масс, а также условия электронейтральности и массового баланса:
Оценку рН буферных растворов выполняют на основе анализа ионных равновесий, характеризующих данный буфер. Например, для двухкомпонентной буферной смеси слабой кислоты НА и ее соли NaA ионные равновесия можно представить набором уравнений, включающих закон действующих масс, а также условия электронейтральности и массового баланса:
[H+] [A-] = K НА [HA];
[H+] [OH-] = Kw;
[H+] +[Na+] = [OH-] + [A-]; (6.17)
[HA] + [A-] = c HA + c NaА;
[Na+] = c NaA).
Сочетая эти уравнения при условии, что величины [H+] и [OH-] пренебрежимо малы по сравнению с аналитическими концентрациями кислоты и соли c HA и c NaA, а также допуская, что [A-] = c NaA и [HA] = c HA можно получить следующую простую формулу для расчета рН буфера (формула Хендерсона):
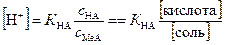 . (6.18)
. (6.18)
Подобным же образом нетрудно вывести выражение для оценки рН смеси слабого основания и его соли.
При использовании уравнения (6.18) необходимо иметь в виду, что оно не выполняется если:
· кислота является слишком сильной - нельзя пренебречь величиной [H+], или слишком слабой – нельзя пренебречь [OH-].
· аналитические концентрации c HA и c NaA слишком малы (по грубым оценкам меньше 10-3 моль/л).
Эффективность буферирования характеризуют буферной емкостью[12] (b) равной:
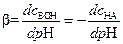
где: сМеОН и с НА - концентрация сильной щелочи или кислоты, специально добавляемых к буферному раствору.
Буферная емкость кислотно-основного буфера соответствует числу эквивалентов сильной кислоты или щелочи, которое необходимо добавить к одному литру раствора, чтобы изменить его рН на единицу. Величина b возрастает при увеличении начальных концентраций образующих буфер компонентов и максимальна приих равенстве. Из формулы (6.18) следует, при изменении соотношения между компонентами буфера в 10 раз (например, от значения 1:1 до значения 1:10) рН изменится на единицу. Этот интервал изменения отношения концентраций принимают за максимально возможный для буферных смесей. Смесь теряет свойства буфера при более высоких соотношениях концентраций составляющих компонентов.
|
|
Для двухкомпонентной буферной смеси буферную емкость можно рассчитать по уравнению:
 (6.19)
(6.19)
Типичным буфером рН является ацетатный буфер, Бриттона - Вальполя (см. табл.6.4). Этот буфер представляет собой смесь уксусной кислоты и ацетата натрия, концентрации которых задают соответственно требуемому значению рН в пределах рабочего диапазона рН (см. табл. 6.4).
Таблица 6.4



