* В ионных равновесиях принимают участие ионы гидроксония H3O+, а не H+, а также активности ионов, а не их концентрации. Ради упрощения записей здесь и в дальнейшем вместо H3O+ и а (H3O+) использованы обозначения H+ и [H+] или a (H+).
Из данных таблицы 6.2 следует, что гидролиз по отдельным ионам описывается соответствующей концентрационной константой равновесия К р и константой гидролиза К г[11]. Последняя представляет собой произведение константы равновесия на стадии протолиза и концентрации воды [H2O], которую для разбавленных растворов можно принять постоянной.
Если числитель и знаменатель правой части уравнения (2), приведенного в табл. 6.2 умножить на [H+], то будет получено выражение, позволяющее рассчитывать константы гидролиза на основе справочных данных по константам диссоциации и ионному произведению воды
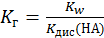 (6.16)
(6.16)
Гидролиз солей, образованных многозарядными ионами протекает ступенчато. В обычных условиях (без внешнего воздействия, например, нагревания) гидролиз протекает преимущественно по первой ступени. Так, уравнение реакции гидролиза соли CuCl2 в ионно-молекулярном виде по первой ступени записывается следующим образом:
Cu2+ + H2O = СuОН+ + Н+, рН < 7
в молекулярной форме
CuCl2 + H2O=CuOHCl + HCl.
Константа гидролиза К г для этой ступени:
К г = [ а (CuOH+). a (H+)]/ a (Cu2+).
Уравнение для второй ступени будет иметь вид:
СuОН+ + H2O = Сu(ОН)2 + Н+.
Если соль образована сильным основанием и слабой кислотой, то гидролизу подвергается анион соли. Например, гидролиз Na2CO3 следует представлять уравнениями:
CO32- + H2О= HCO3- + ОН-, рН > 7
Na2CO3 + H2O = NaHCO3 + NaOH.
Если соль образована слабым основанием и слабой кислотой, то гидролизу подвергаются и анион, и катион. Например, для гидролиза (NH4)2S имеем
2NH4+ + S2- + 2H2O = 2NH4OH + H2S,
(NH4)2S + 2H2O = 2NH4OH + H2S.
Таким образом, возможны три случая гидролиза. Гидролиз по катиону или аниону сопровождается изменением рН раствора (вследствие появления некоторого избытка ионов Н+ или ОНˉ). Если с водой взаимодействуют и катион, и анион одновременно, то величина рН определяется соотношением концентраций ионов Н+ или ОНˉ. Эти концентрации нетрудно вычислить, если известны константы диссоциации соответствующих кислоты и основания.
|
|
Иногда о степени гидролиза (протолиза) судят по величине параметра a, называемого степенью гидролиза. Величину a определяют как долю ионов Н+ или ОНˉ от исходной концентрации соли. Например, для гидролиза по аниону используют соотношение a = [OHˉ]/ c o, где c o - исходная концентрация соли.
Надо отметить, что соли, образованные сильным основанием и сильной кислотой, например, Na2SO4, NaCl, гидролизу не подвергаются. Это следует из определения понятия гидролиз.
К числу факторов, существенно влияющих на характер гидролиза можно отнести разбавление и нагревание раствора соли, а также введение добавок кислоты или щелочи. С разбавлением возрастает концентрация одного из реагентов (воды), поэтому в соответствии с принципом Ле Шателье гидролиз усиливается. Напротив, гидролиз концентрированных растворов солей протекает в меньшей степени. Повышение температуры влияет на гидролиз главным образом вследствие изменения степени диссоциации воды. При нагревании концентрация ионов Н+ и ОН¯ сильно возрастает. Это увеличивает вероятность связывания их с образованием малодиссоциированной кислоты или основания и приводит к тому, что при повышении температуры гидролиз протекает полнее.
Влияние добавок кислоты или щелочи определяется природой соли, которая подвергается гидролизу. В частности, добавки кислоты к раствору соли, образованной сильной кислотой, но слабым основанием дополнительно увеличивает концентрацию Н+, что в конечном итоге подавляет гидролиз. Добавки щелочи в этом случае способствуют гидролизу


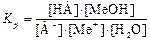 (5)
(5)



