
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Компонентов для буфера Бриттона- Вальполя
Сущность буферного действия этой системы следует рассматривать на основе анализа природы ионных равновесий: СН3СООNа =СН3СОО-+Na+, CH3COOH = CН3COO- + H+. Ацетат натрия является сильным электролитом. Поэтому он нацело диссоциирует на ионы CH3COO- и Nа+. Уксусная кислота диссоциирует слабо, поскольку константа диссоциации у нее очень мала (Кдис = 1,75.10-5) и к тому же большое количество анионов CH3COO-, введенных в раствор вместе, с солью, смещает равновесие диссоциации уксусной кислоты в сторону образования недиссоциированных молекул. Равновесия в системе ацетатного буфера можно описать с помощью концентрационной константы диссоциации уксусной кислоты (К дис), т.е.: К дис = [Н+].[CH3COO-]/[CH3COOH] В присутствии ацетата натрия, подавляющего диссоциацию кислоты, можно принять, что концентрация молекул недиссоциированной кислоты равна исходной концентрации кислоты, т.е. [CH3COOH] = [кислота], а общая концентрация [CН3СOO-] практически равна аналитической концентрации соли. Отсюда следует, что [CH3COO-] = [соль]. С учетом этого соотношения имеем: [H+] После логарифмирования (6.20) и изменения знаков получается выражение: - lg[Н+] = - lg К дис- lg [кислота] + lg[соль] (6.21) или рН = р К дис- lg [кислота] + lg[соль] (6.22) где рК дис - отрицательный логарифм константы диссоциации кислоты. При добавлении кислоты (например, соляной) к ацетатному буферу происходит обменная реакция CH3COONa + HCl = NaCl + CH3COOH В результате этой реакции сильная кислота заменяется эквивалентным количеством слабой кислоты. В соответствии с законом разведения Оствальда увеличение концентрации уксусной кислоты понижает степень ее диссоциации. Поэтому концентрация ионов водорода в растворе увеличивается крайне незначительно. К дис = [α2 с (СН3СООН)]/(1 – α) где K дис и α - константа и степень диссоциации CH3COOH соответственно. При введении в буферный раствор небольших количеств щелочи происходит реакция нейтрализации, результате которой ионы ОН- оказываются связанными уксусной кислотой с образованием слабодиссоциирующей воды:
CH3COOH + NaOH = H2O + СН3СООNа, В итоге ионное равновесие восстановится, а величина рН практически не изменится. Разбавление также мало влияет на величину рН буферных растворов. Это связано с тем, что рН буферных растворов, как следует из уравнения (6.20), зависит главным образом от соотношения концентраций составляющих буфер компонентов (кислоты и соли или основания и соли). Разбавление не может существенно изменить ни это соотношение, ни активность ионов гидроксония, что и определяет постоянство рН буфера. Опыт показывает, что даже значительное (в 10...20 раз) разбавление буферных растворов почти не меняет рН. Приведенная интерпретация механизма буферного действия справедлива и для буферных растворов, состоящих из смеси слабого основания и соли, образованной ионами металла этого основания и кислотным остатком какой-либо сильной кислоты. В этом случае уравнение (6.22) будет иметь вид: рН = р К ос+ lg[соль] - lg[основание], (6.23) где р К ос - отрицательный логарифм константы диссоциации основания. Буферная способность белков молока объясняется наличием аминных и карбоксильных групп [6]. Контрольное задание 22 Выберите и обоснуйте правильное утверждение. 22.1. Область буферирования рН основного буферного раствора можно изменить, добавляя к составу буфера: а) щелочь; б) соль. 22.2. Максимальное значение буферной емкости для выбранного диапазона рН кислотного буфера можно достигнуть, увеличивая: а) концентрацию кислоты; б) одновременно концентрации кислоты и соли; 22.3. Формула Хендерсона в случае кислотного буфера имеет вид
Если принять, что К НА = const, то основным и достаточным условием ее применения является: а)[ кислота ] =[ соль ] и [ кислота ] >> [Н+]; б)[ кислота ] >[ соль ] и [ соль ] >> [ОН¯]; в)[ кислота ] >>[Н+] и [ соль ] >> [ОН¯]. 22.4. Обязательным и достаточным условием гидролиза является изменение рН: а. правильно; б. неправильно;
|
||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2020-12-17; просмотров: 79; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.144.205.223 (0.01 с.) |
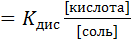 . (6.20)
. (6.20)
 .
.


