
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Транспортные явления в растворах электролитов ⇐ ПредыдущаяСтр 8 из 8
Диффузия (от лат. diffusio – распространение, растекание, рассеивание), перенос вещества, обусловленный хаотическим тепловым движением молекул в газах или конденсированных средах. В наиболее общем подходе к рассмотрению этого явления принимается, что движущей силой диффузии является градиент химического потенциала. Поток диффузии j д, т.е. количество частиц, диффундирующих через единичную площадку в единицу времени, пропорционален концентрации этих частиц ci и градиентухимического потенциала: j д = - k д с i grad m i (6.24) где k д - коэффициент пропорциональности, величина которого определяется средней длиной перескоков иона и необходимой для этих перескоков энергией активации. Знак "-" указывает на уменьшение концентрации частиц в процессе диффузии в зоне из которой движутся эти частицы.
В частном случае для двухкомпонентной системы при постоянных давлении и температуре, а также при условии, что градиент химического потенциала определяется преимущественно концентрационными изменениями из уравнения (6.24) с учетом соотношения (2.76) m i = m i 0 + RT ln ci можно вывести выражение, известное под названием первый закон Фика. где: Ni - число продиффундировавших молекул, dci / dx - градиент молярной концентрации (изменение молярной концентрации, отнесенное к единице расстояния х), s- площадь поперечного сечения, через которое происходит диффузия, Di - коэффициент диффузии вещества i (ед. изм.- м2·с-1 или см2·с-1). Коэффициент диффузии является наиболее важной характеристикой процесса диффузии. Физический смысл этого коэффициента нетрудно понять из уравнения (6.25). Действительно, коэффициент диффузии численно равен числу молекул диффундирующего вещества при условии, что градиент концентрации, время диффузии, а также величина s равны единице. Первый закон Фика удовлетворительно описывает стационарную диффузию, при которой величина градиента концентрации практически не меняется. Если протекает нестационарный процесс и градиент концентрации не является постоянной величиной, для описания диффузии применяют уравнение, представляющее второй закон Фика.
Можно отметить, что уравнения закона Фика представляют частный случай наиболее общей зависимости (6.24), который объясняет процесс исключительно концентрационными изменениями и наличием градиента концентрации[13]. Из уравнений, характеризующих законы Фика, следует, что конечным итогом диффузии является выравнивание концентрации диффундирующего вещества по всему объему реакционной системы. Поэтому часто этот случай диффузии называют концентрационной диффузией
Миграция - транспорт заряженных частиц (ионов, частиц дисперсной фазы) под действием градиента электрического потенциала. Этот вид транспорта вещества имеет существенное значение при рассмотрении явлений, протекающих вблизи заряженных поверхностей или непосредственно на этих поверхностях. Миграция ионов, в частности, составляет основу электропроводности электролитов. Поэтому многие электрохимические процессы, а также электрокинетические явления в дисперсных системах невозможно объяснить, не привлекая представлений о миграции заряженных частиц. Конвекция - Перемещение жидкой или газовой среды как целого. Различают свободную и вынужденную конвекцию. Если причиной движения является разность концентраций, то говорят о свободной или естественной конвекции. Если перемещение вызывают внешние силы, то процесс называют вынужденной конвекцией. Характер вынужденной конвекции во многом зависит от характера движения слоев жидкости или газа. Различают ламинарный и турбулентный режимы движения среды. Ламинарным является упорядоченное, стационарное движение, характеризующееся одинаковой для всех точек массового потока скоростью движения. Какие- либо возмущения внутри потока или на его границе при ламинарном движении отсутствуют. Турбулентным называется неупорядоченное нестационарное перемещение вещества, в котором невозможно выделить отдельные ламинарные потоки, а скорости движения массы в отдельных точках турбулентного потока непрерывно меняются во времени непредсказуемым образом. Осмос. Самопроизвольный переход (диффузия) растворителя через полупроницаемую мембрану из растворителя в раствор или из раствора с низкой концентрацией растворенного вещества в раствор с высокой концентрацией растворенного вещества. Результатом осмоса является выравнивание концентраций растворенного вещества по обе стороны мембраны. Поэтому растворитель всегда переходит через мембрану в сторону более концентрированного раствора[14].
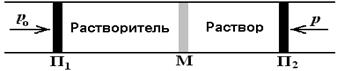
Наряду с такими свойствами как понижение температуры замерзания и повышение температуры кипения и понижение давления пара растворителя, осмос относят к к оллигативным свойствам растворов, которые зависят только от количества частиц растворенного вещества и не зависят от природы этих частиц. Сила, заставляющая растворитель переходить через мембрану - это осмотическое давление. Продемонстрировать возникновение осмотического давления можно при помощи рисунка 6.4
Рис. 6.4 Соотношение между осмотическим давлением раствора p и внешними гидродинамическими давлениями р и р о. На рисунке показаны камеры, содержащие растворитель и растворенное вещество разделенные неподвижной проницаемой для растворителя мембраной (М) ограниченные с торцов подвижными (способными перемещаться без трения) непроницаемыми поршнями (П1 и П2). Чтобы скомпенсировать осмотическое давление и обеспечить неизменность, объема раствора к раствору и растворителю надо приложить различные внешние гидродинамические давления р и р о . Разность между этими давлениями равна осмотическому давлению (p), т.е.: p = р - р о С термодинамической точки зрения осмотическое давление можно определить как параметр, характеризующий стремление раствора к понижению концентрации при соприкосновении с чистым растворителем, вследствие встречной диффузии молекул растворенного вещества и растворителя. Причиной появления осмотического давления является стремление системы выровнять значения химических потенциалов по обе стороны мембраны. Это закономерно вытекает из принципа минимизации свободной энергии термодинамической системы. Количественные оценки осмотического давления впервые предложил Вант Гофф. Он установил, что осмотическое давление разбавленного раствора неэлектролита численно равно давлению, которые могли бы оказать молекулы растворенного вещества, если бы они находились в газообразном состоянии при тех же значениях температуры (T) и концентрации растворенного вещества (c), т.е.: p = cRT, (6.27) По форме выражение Вант Гоффа[15] совпадает с уравнением состояния идеального газа. Однако сходство между названными формулами лишь формально. Природа осмоса носит диффузионный характер. Осмос ни в коем случае нельзя представлять, как результат механических ударов молекул о стенки мембраны. Физический смысл осмотического давления следует связывать с неким диффузионным давлением, возникающем на границе раздела растворов с разной концентрацией. Это давление, как следует из рис. 6.4, численно равно гидростатическому давлению, которое надо приложить к раствору для предотвращения осмоса и установления осмотического равновесия. При расчете осмотического давления растворов электролитов следует учитывать увеличение общей концентрации растворенных частиц, вводя изотонический коэффициент i:
p = i cRT. (6.27 а) Изотонический коэффициент является поправкой на увеличение общего числа частиц за счет диссоциации. Величину i можно рассчитать по формуле (1.6). Механизм осмоса зависит прежде всего от природы мембраны. Часто мембрана взаимодействует с растворителем образуя непрочные промежуточные соединения. В других случаях через мембрану проходят те вещества, которые способны раствориться в ней. Растворы с одинаковым осмотическим давлением называют изотоническими. Если один из двух сравниваемых растворов имеют более высокое значение осмотического давления, его называют гипертоническим, если давление этого раствора ниже давления сравниваемого раствора, его называют гипотоническим. Осмотическое давление измеряют с помощью осмометра. Наиболее просто величину осмотического давления определить, измеряя избыточное гидростатическое давление по высоте столба жидкости в трубке осмометра после установления осмотического равновесия (рис. 6.5.).
Рис. 6.5. Принципиальная схема осмометра: А - камера с растворителем; В - камера с раствором; М - мембрана. h - столб жидкости уравновешивающий осмотическое давление. Измерение осмотического давления имеет большое практическое и общенаучное значение. В частности, молярные массы многих веществ можно установить на основе данных осмоса. Обратный осмос заключается в фильтровании растворов под давлением через полупроницаемые мембраны, пропускающие растворитель и полностью или частично задерживающие ионы или молекулы растворенного вещества. Движущей силой обратного осмоса в случае идеально полупроницаемой перегородки является избыточное давление (р) над исходным раствором. Избыток давления определяется по формуле: D p = p - p. Пример осмотических явлений, возникающих в солевых системах, - рост искусственной клетки на поверхности желтой кровяной соли, кристаллы которой находятся в растворе сульфата меди. В этой системе кристаллы желтой кровяной соли взаимодействуют с сульфатом меди по уравнению: 2CuSO4 + K4[Fe(CN)6] = Cu2[Fe(CN)6] + 2K2SO4. На поверхности кристаллов возникает полупроницаемая пленка соли Cu2[Fe(CN)6], которая изолирует кристаллики от водного раствора. Молекулы воды проходят под действием осмотических сил через пленку, накапливаются внутри клетки, увеличивая ее объем и, наконец, разрывают пленку. В результате содержимое клетки выходит наружу, а к поверхности кристалликов поступают новые порции сульфата меди. Вновь образуется пленка и начинается осмотический процесс, при котором продолжается рост искусственной клетки с образованием отростков в тех местах, где происходили разрывы полупроницаемой пленки. Процесс идет до тех пор, пока не выработается один из компонентов.
Осмос имеет исключительное значение для жизни живых организмов. С ним связывают такие явления, как тургор и плазмолиз. Тургор проявляется на уровне растительных клеток. Вода, проникая через мембраны этих клеток, создает осмотическое давление. Это давление поддерживает упругость тканей растения и обеспечивает его рост. Плазмолиз возникает в клетках живых организмов, находящихся в сильно минерализованной среде. Он вызывается переходом воды под действием осмоса через клеточные мембраны из живых тканей в минерализованную среду. Потеря клеткой воды приводит к ее гибели. Плазмолиз проявляется при консервировании продуктов питания в растворах поваренной соли или сахара. Известно, например, что в концентрированном сахарном сиропе осмотическое давление может достигать значений 30 -50 МПа, что практически всегда вызывает плазмолиз микроорганизмов при варке варения. Контрольное задание 23 Выберите и обоснуйте правильное утверждение. 23.1. Увеличение внешнего давления приводит к: а) увеличению осмотического давления; б) уменьшению осмотического давления; в) не меняет осмотическое давление. 23.2. При попадании в чистую воду эритроцитов крови вода окрашивается. Причиной этого явления является: а) химическое взаимодействие эритроцитов с водой; б) осмотическое давление. Вопросы 1. Каковы причины образования ассоциатов в растворах? 2. Как давление влияет на растворимость газа в жидкости? 3. Для приготовления литра 40% этанола следует взять 444 см3 90% раствора этанола и 581 см3 воды. Объясните, почему формально суммированный объем реагентов превышает 1000 см3? 4. Определите энтальпию растворения тростникового сахара в воде по данным для растворимости в 100 г воды при разных температурах
5. Две одноосновные органические кислоты при одинаковой молярной концентрации имеют степени диссоциации: первая -0,2, вторая -0,5. Константа диссоциации какой кислоты больше и во сколько раз? 6. Что означает термин "коллигативные свойства"? В чем проявляются эти свойства? 7. Давление пара водного раствора, содержащего нелетучее растворенное вещество, на 2 % ниже давления пара чистой воды. Определите моляльную концентрацию растворенного вещества. 8. Определите температуру кипения 2,0 % водного раствора глюкозы. Эбуллиоскопическая постоянная для воды - 0,512. 9. При температуре 27оС осмотическое давление раствора сахара в воде равно 1,0133·105 Па. Определите осмотическое давление этого раствора при 0 оС. Рассчитайте навеску, хлорида кальция которую необходимо взять, чтобы приготовить 100 см3 водного раствора изотоничного с этим раствором сахара при 0оС.
10. Сколько глицерина должно быть растворено (в %), чтобы давление пара раствора было на 2% ниже давления пара воды? 11. Выполните анализ единой схемы электролитической диссоциации, учитывающей явления сольватации и ассоциации. 12. Чем "ионогены" отличаются от “ионофоров”? Приведите механизм растворения ионофоров и ионогенов в воде. 13. Что такое ионная атмосфера? Какие факторы определяют радиус ионной атмосферы? 14. Приведите основные положения теории электролитов Аррениуса. В чем основные недостатки этой теории? 15. В чем состоит правило ионной силы? Приведите основные формулы для расчета ионной силы. 16. Приведите сущность явления осмос. Как можно рассчитать осмотическое давление растворов электролитов и неэлектролитов? 17. Рассчитайте осмотическое давление молока при нормальных условиях, если известно, что его температура замерзания в среднем равна -0,54 оС. 18. Кажущаяся степень диссоциации раствора, состоящего из 5,0 г хлористого натрия в 100 г воды равна 0,8. Рассчитайте температуру замерзания раствора (К к=1,86 °С)? 19. Рассчитайте навеску соли, которую необходимо взять, чтобы приготовить раствор заданной аналитической концентрации. Плотность растворов примите равной 1 г/см3. Формулу соли, объем раствора и аналитическую концентрацию, соответствующую вашему варианту см в табл. Таблица Исходные данные к расчетам навески соли для приготовления раствора
Оцените возможность гидролиза в растворе соли, соответствующей вашему варианту. Приведите уравнения гидролиза и оцените рН раствора. - Если гидролиз в растворе соли заданного варианта не идет предложите формулу соли, подвергающейся гидролизу, и обоснуйте выбор. - Рассчитайте ионную силу смесей, полученных смешиванием в равных объемах растворов, приведенных в таблице. Смешиваются два соседних раствора. Вариант отвечает раствору с меньшим номером. - С учетом найденного значения ионной силы рассчитайте значения коэффициентов активности для ионов соли заданного варианта. Обоснуйте выбор использованного для расчета уравнения. [*] Здесь и в дальнейшем предполагается, что ионы в растворе сольватированы. [†] Следует помнить, что при расчетах ионной силы нейтральные частицы не учитывается, поскольку они не влияют на величину электростатических взаимодействий. [1] Д. И. Менделеев на основе исследований плотности спиртовых растворов одним из первых пришел к выводу, о наличии взаимодействия между растворителем и растворяемым веществом. [2] Такую сольватацию называют универсальной сольватацией и уподобляют процессу конденсации, т. е. переходу вещества из парообразного состояния в жидкое. В то же время допускается рассматривать конденсацию как автосольватацию самих молекул растворителя. Нередко вводят понятия идеальной и реальной сольватации. В таком случае акцент делается на характере структуры основной массы растворителя. Принимается, что эта структура при идеальной сольватации не нарушена и раствор обладает свойствами бесконечно разбавленного раствора. При реальной сольватации взаимодействие сольватированных частиц с молекулами растворителя существенно меняет данную структуру. [3] Иногда электролитами называют жидкие или твердые вещества и системы, способные проводить электрический ток с помощью присутвтвующих в них ионов. [4] На это обстоятельство обращал внимание Д.И. Менделеев. Он замечал, что с принятием представлений о диссоциации Аррениуса "становится необходимым принять в растворе свободные ионы, подобные атомам Cl или Na, происшедшими без видимой затраты энергии, необходимой для их разъединения". [5] Термин "сольватация" был введен И.А. Каблуковым в 1891 году, чтобы обозначить взаимодействия,которые возникают между растворенным веществом и растворителем. [6] Уравнение (6.2) представляет закон разведения Оствальда. Это уравнение получают, учитывая, что [M+] = [A-] = acо, а [MA] = (1- a)cо. Следует иметь в виду, что квадратные скобки - символ только равновесной молярной концентрации некоторого вещества В (моль/л). Другие выражения концентраций или неравновесные молярные концентрации обозначать этим символом не рекомендуется. [7] Образование ассоциатов в значительной мере характерно для неводных растворителей. Но и в случае водных растворов наличие ассоциатов является доказанным фактом. В частности, установлено наличие таких образований как BaCl+, AgCl2-, LiCl2-. [8] Следует отметить, что в зависимости от единиц измерения концентрации меняется и обозначение, и численная величина коэффициента активности и ионной силы. См. табл.
[9] Средний ионный коэффициент активности электролита y± равен y± = (y+ l y- m)1/ l+ m. Средняя ионная концентрация с ± равна с ± = (с + l с- m)1/ l+ m. [10] Наряду с гидролизом солей этим термином обозначают и взаимодействие с водой других классов химических веществ: углеводов, белков, эфиров, бинарных соединений, в числе которых карбиды, нитриды, фосфиды и пр. Поэтому нередко гидролиз определяют, как обменное взаимодействие молекул растворенного соединения с водой. В этом случае как бы признается, что при растворении вещество переходит в раствор в молекулярном виде, что в случае электролитов как было показано выше не так. [11] Константу гидролиза в литературе иногда путают с константой основности. Для протолитического равновесия типа А-+ Н2О = Н2О+ ОН- константа основности имеет вид [12] Термин буферная емкость (buffer index) ввел Д.Д. ван Слайк в 1922 г. Иногда ее определяют как обратный наклон, имея ввиду наклон кривой титрования равный d pH / dc. [13] Иногда пользуются записью уравнения закона Фика (6.25), в которой градиент концентрации заменяют на градиент плотности диффундирующего вещества, т.е.: [14] Ярким примером проявления осмоса в природе служит тургор – перемещение воды через мембраны растительных клеток. Упругость зеленой массы растений в первую очередь связывают именно с этим явлением. В пищевых технологиях осмос проявляется при консервировании продуктов в концентрированных солевых или сахарных средах. В таких средах микроорганизмы гибнут вследствие обезвоживания, которое вызывают силы осмотического давления.. [15] Следует отметить, что закон Вант-Гоффа и понятие осмотического давления имеют смысл только в отношении очень разбавленных солевых растворов и коллоидных систем. В случае растворов полимеров (в том числе природных, типа полисахаридов или белков) часто пользуются выражением для осмотического давления, содержащим вириальные осмотические коэффициенты: p= RT (c 2M2 + A2 c 22 + A3 c 23 + ….) где М2 - молекулярная масса полимера, А2, А3 - вириальные коэффициенты, зависящие от формы молекул и характера межмолеулярных сил, действующих между этими молекулами. Для полисахаридов в водных растворах 0,15 -0,2 М соли значения второго вирального коэффициента равны примерно 2,3 ∙10-3 моль∙см3/г2 [Биохимическая термодинамика. Под ред. М.Джоунс. Пер с англ. "Мир", М. 1982, с 196-197.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2020-12-17; просмотров: 150; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.117.72.224 (0.047 с.) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||



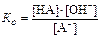 .
. где m i - масса диффундирующего вещества, r - плотность вещества i.
где m i - масса диффундирующего вещества, r - плотность вещества i.


