
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Моль. Закон авогадро. Молярный объем газа.Содержание книги
Поиск на нашем сайте
Моль (n) - кол-во вещества, содержащее столько структурных единиц (молекул, атомов, ионов и др.), сколько атомов содержится в 12 г (0,012 кг) изотопа углерода 12С 1моль вещества содержит 6,02*1023 структурных единиц (число Авогадро, NА) Формулы, отражающие взаимосвязь объема вещества, его массы и молекулярной массы.
Где m-масса,M-молярная масса, V- объем. 4. Закон Авогадро. Установлен итальянским физиком Авогадро в 1811 г. Одинаковые объемы любых газов, отобранные при одной температуре и одинаковом давлении, содержат одно и тоже число молекул. Таким образом, можно сформулировать понятие количества вещества: 1 моль вещества содержит число частиц, равное 6,02*1023 (называемое постоянной Авогадро) Следствием этого закона является то, что 1 моль любого газа занимает при нормальных условиях (Р0 =101,3кПа и Т0=298К) объём, равный 22,4л. 5. Закон Бойля-Мариотта При постоянной температуре объем данного количества газа обратно пропорционален давлению, под которым он находится: PV = const. 6. Закон Гей-Люссака При постоянном давлении изменение объема газа прямо пропорционально температуре: V/T = const. 7. Зависимость между объемом газа, давлением и температурой можно выразить объединенным законом Бойля-Мариотта и Гей-Люссака, которым пользуются для приведения объемов газа от одних условий к другим: P0, V0,T0-давление объема и температуры при нормальных условиях: P0=760 мм рт. ст. или 101,3 кПа; T0=273 К (00С)
8. Независимая оценка значения молекулярной массы М может быть выполнена с использованием так называемого уравнения состояния идеального газа или уравнения Клапейрона-Менделеева: pV=(m/ M) *RT= vRT. (1.1) где р — давление газа в замкнутой системе, V — объем системы, т — масса газа, Т — абсолютная температура, R — универсальная газовая постоянная. Отметим, что значение постоянной R может быть получено подстановкой величин, характеризующих один моль газа при н.у., в уравнение (1.1): r = (р V)/(Т)=(101,325кПа 22.4 л)/(1 моль 273К)=8.31Дж/моль.К)
Примеры решения задач Пример 1. Приведение объема газа к нормальным условиям. Какой объем (н.у.) займут 0,4×10-3 м3 газа, находящиеся при 500С и давлении 0,954×105 Па?
Решение. Для приведения объема газа к нормальным условиям пользуются общей формулой, объединяющей законы Бойля-Мариотта и Гей-Люссака:
pV/T = p0V0/T0. Объем газа (н.у.) равен
При (н.у.) газ занимает объем, равный 0,32×10-3 м3.
Пример 2. Вычисление относительной плотности газа по его молекулярной массе. Вычислите плотность этана С2Н6 по водороду и воздуху. Решение. Из закона Авогадро вытекает, что относительная плотность одного газа по другому равна отношению молекулярных масс (Мч) этих газов, т.е. D=М1/М2. Если М1 С2Н6 = 30, М2 Н2 = 2, средняя молекулярная масса воздуха равна 29, то относительная плотность этана по водороду равна DН2 = 30/2 =15. Относительная плотность этана по воздуху: Dвозд = 30/29 = 1,03, т.е. этан в 15 раз тяжелее водорода и в 1,03 раза тяжелее воздуха.
Пример 3. Определение средней молекулярной массы смеси газов по относительной плотности. Вычислите среднюю молекулярную массу смеси газов, состоящей из 80 % метана и 20 % кислорода (по объему), используя значения относительной плотности этих газов по водороду. Решение. Часто вычисления производят по правилу смешения, которое заключается в том, что отношение объемов газов в двухкомпонентной газовой смеси обратно пропорционально разностям между плотностью смеси и плотностями газов, составляющих эту смесь. Обозначим относительную плотность газовой смеси по водороду через D Н2. она будет больше плотности метана, но меньше плотности кислорода:
80 D Н2 – 640 = 320 – 20 D Н2; D Н2 = 9,6.
Плотность этой смеси газов по водороду равна 9,6. средняя молекулярная масса газовой смеси М Н2 = 2 D Н2 = 9,6×2 = 19,2.
Пример 4. Вычисление молярной массы газа. Масса0,327×10-3 м3 газа при 130С и давлении 1,040×105 Па равна 0,828×10-3 кг. Вычислите молярную массу газа.
Решение. Вычислить молярную массу газа можно, используя уравнение Менделеева-Клапейрона:
где m – масса газа; М – молярная масса газа; R – молярная (универсальная) газовая постоянная, значение которой определяется принятыми единицами измерения. Если давление измерять в Па, а объем в м3, то R =8,3144×103 Дж/(кмоль×К).
|
|||||||||||
|
Последнее изменение этой страницы: 2020-12-09; просмотров: 120; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.147.86.30 (0.01 с.) |


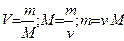
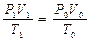
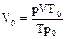 , где Т0 = 273 К; р0 = 1,013×105 Па; Т = 273 + 50 = 323 К;
, где Т0 = 273 К; р0 = 1,013×105 Па; Т = 273 + 50 = 323 К;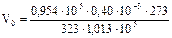 м3 = 0,32×10-3 м3.
м3 = 0,32×10-3 м3.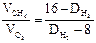 ;
; 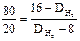 ;
;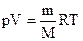 ,
,


