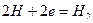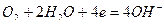Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Способы устранения жесткости воды.
При контроле качества воды определяют ее жесткость. Определение карбонатной жесткости воды проводят методом нейтрализации. В основе этого метода лежит титрование воды в присутствии метилового оранжевого раствором соляной кислоты до перехода желтой окраски индикатора в оранжевую. Для определения общей жесткости применяют метод комплексонометрии. В основе этого метода лежит титрование воды в присутствии буферного раствора (рН=10.0) и индикатора хромогена черного раствором комплексона III (трилона Б) до перехода винно-красной окраски в синюю. Комплексон III – двузамещенная натриевая соль этилендиаминтетрауксусной кислоты
HOOCH2C CH2COONa
При титровании жесткой воды раствором комплексона III образуется внутрикомплексное соединение.
При этом связываются ионы Са2+ и Mg2+.
16.5. Коррозия — это самопроизвольно протекающий процесс разрушения металлов в результате химического или электрохимического взаимодействия их с окружающей средой. При электрохимической коррозии на поверхности металла одновременно протекают два процесса: анодный — окисление металла
и катодный — восстановление ионов водорода
или молекул кислорода, растворенного в воде,
Ионы или молекулы, которые восстанавливаются на катоде, называются деполяризаторами. При атмосферной коррозии — коррозии во влажном воздухе при комнатной температуре — деполяризатором является кислород.
Коррозия металлов - это процесс их химического разрушения под действием окружающей среды.
Виды коррозии металлов.
|
||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2020-12-09; просмотров: 70; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 13.58.244.216 (0.006 с.) |

 NaOOCH2C CH2COOH
NaOOCH2C CH2COOH



 NaOOCH2C CH2COO
NaOOCH2C CH2COO