
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Типы защиты металлов от коррозии.
16.7. Примеры решения задач. Пример.1. Как происходит коррозия цинка, находящегося в контакте с кадмием в нейтральном и кислом растворах. Составьте электронные уравнения анодного и катодного порцессов. Каков состав продуктов коррозии? Решение. Цинк имеет более отрицательный потенциал (—0,763 В), чем кадмий (—0.403 В), поэтому он является анодом, а кадмий катодом. анодный процесс: катодный процесс: в кислой среде в нейтральной среде: Так как ионы
Задания для контрольной работы. 301. Как происходит атмосферная коррозия луженого и оцинкованного железа при нарушении покрытия? Составьте электронные уравнения анодного и катодного процесса. 302. Медь не вытесняет водород из разбавленных кислот. Почему? Однако если к медной пластинке, опушенной в кислоту, прикоснуться цинковой, то на меди начинается бурное выделение водорода. Дайте этому объяснение, составив электронные уравнения анодного и катодного процессов. Напишите уравнение протекающей химической реакции. 303. Как происходит атмосферная коррозия луженого железа и луженой меди при нарушении покрытия? Составьте электронные уравнения анодного и катодного процессов. 304. Если пластинку из чистого цинка опустить в разбавленную кислоту, то начинающееся выделение водорода вскоре почти прекращается. Однако при прикосновении к цинку медной палочкой па последней начинается бурное выделение водорода. Дайте этому объяснение, составив электронные уравнения анодного и катодного процессов. Напишите уравнения протекающей химической реакции.
305. В чем сущность протекторной защиты металлов от коррозии? Приведите пример протекторной защиты железа в электролите, содержащем растворенный кислород. Составьте электронные уравнения анодного и катодного процессов. 306. Железное изделие покрыли никелем. Какое это покрытие — анодное или катодное? Почему? Составьте электронные уравнения анодного и катодного процессов коррозии этого изделия при нарушении покрытия во влажном воздухе и хлороводородной (соляной) кислоте. Какие продукты коррозии образуются в первом и втором случаях 307. Составьте электронные уравнения анодного и катодного процессов с кислородной и водородной деполяризацией при коррозии пары магний—никель. Какие продукты коррозии образуются в первом и во втором случаях? 308.В раствор хлороводородной (соляной) кислоты поместили цинковую пластинку, частично покрытую медью. В каком случае процесс коррозии цинка происходит интенсивнее? Ответ мотивируйте, составив электронные уравнения соответствующих процессов. 309.Почему химически чистое железо более стойко против коррозии, чем техническое железо? Составьте электронные уравнения анодного и катодного процессов, происходящих при коррозии технического железа во влажном воздухе и в кислой среде. 310. Какое покрытие металла называется анодным и какое — катодным? Назовите несколько металлов, которые могут служить для анодного и катодного покрытия железа. Составьте электронные уравнения анодного и катодного процессов, происходящих при коррозии железа, покрытого медью, во влажном воздухе и кислой среде. 311. Железное изделие покрыли кадмием. Какое это покрытие — анодное или катодное? Почему? Составьте электронные уравнения анодного и катодного процессов коррозии этого изделия при нарушении покрытия во влажном воздухе и хлороводородной (соляной) кислоте. Какие продукты коррозии образуются в первом и во втором случаях?
312. Железное изделие покрыли свинцом. Какое это покрытие — анодное или катодное? Почему? Составьте электронные уравнения анодного и катодного процессов коррозии этого изделия при нарушении покрытия во влажном воздухе и хлороводородной (соляной) кислоте. Какие продукты коррозии образуются в первом и во втором случаях? 313. Две железные пластинки, частично покрытые одна оловом, другая медью, находятся во влажном воздухе. На какой из этих пластинок быстрее образуется ржавчина? Почему? Составьте электронные уравнения анодного и катодного процессов коррозии этих пластинок. Каков состав продуктов коррозии железа? 314. Какой металл целесообразней выбрать для протекторной защиты от коррозии свинцовой оболочки кабеля: цинк, магний или хром? Почему? Составьте электронные уравнения анодного и катодного процессов атмосферной коррозии. Каков состав продуктов коррозии? 315 Какой метод умягчения воды называют термическим? Какие химические реакции протекают при умягчении воды этим методом? 316. Как определить общую жесткость воды? 317 На титрование 200 мл H2O израсходовано по 8 мл 0.1Н раствора комплексона III. Вычислите общую жесткость воды. (ответ 4 ммоль/л). 318 Как находят карбонатную жесткость. Напишите уравнения реакций. 319 Вычислите общую жесткость воды, если на титрование 200 мл Н2О израсходовано 7.6 мл 0.05Н комплексона III. 320 Вычислите карбонатную жесткость воды, если на титрование 100 мл Н2О израсходовано 1.5 мл 0.1Н раствора HCl (ответ 1.5 ммоль/л).
|
||||||||||||||||||
|
Последнее изменение этой страницы: 2020-12-09; просмотров: 100; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.118.120.109 (0.005 с.) |
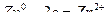



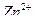 с гидроксильной группой образует нерастворимый гидроксид, то продуктом коррозии будет
с гидроксильной группой образует нерастворимый гидроксид, то продуктом коррозии будет 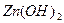 .
.


