
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Скорость химической реакции прямо пропорциональна концентрации реагирующих веществ в степени их стехиометрических коэффициентов.
Для химической реакции mA+nB=D V=K[A]m[B]n (основное кинетическое уравнение) Где [A] и [B] – концентрация веществ m и n – стехиометрические коэффициенты К – константа скорости. Зависимость скорости химической реакции от температуры определяется правилом Вант – Гоффа, которое гласит:
Vt1 – скорость химической реакции до изменения температур Vt2 - скорость химической реакции после изменения температур t1 t2 – температура -
В зависимости от природы реагентов и условий протекания химического процесса различают: необратимые KClO3®KCl+O2↑
и обратимые реакции NH4Cl↔NH3+HCl
В обратимых реакциях наступает момент, когда скорость прямой реакции становится равна скорости обратной реакции, то есть K1[NH4Cl]=K2[NH3][HCl] такое состояние системы называют химическим равновесием. При постоянной температуре отношения скоростей прямой и обратной реакции представляют собой постоянную величину, называемую константой равновесия. Для обратимой реакции при данной температуре, отношение произведения равновесных концентраций продуктов реакций к произведению концентраций исходных веществ, возведенных в степень их стехиометрических коэффициентов, есть величина постоянная, называемая константой равновесия. Для реакции аА+вВ«сС+дД
N2+3H2®2NH3
[NH3], [N2], [H2] – равновесные концентрации
7.2.При изменении внешних условий (температуры, давления, концентрации) нарушается равновесие, называемое смещением или сдвигом равновесия. Направление, в котором происходит смещение, определяется принципом Ле – Шателье. Изменение внешних условий вызывает смещение равновесия в направлении реакции, противодействующей произведенному измерению. Если на систему, находящуюся в равновесии производится внешнее воздействие (изменение С, Т, Р), то в системе развиваются процессы, уменьшающие внешние воздействия.
Пример: 2CO+O2«2CO2 ∆H= -568 кДж/моль
Условия смещения равновесия в стороны продукта: 1. Увеличение концентрации O2 2. Увеличение давления 3. Понижение температуры.
Примеры решения задач. Пример1. Как изменится скорость реакции 2Н2+О2=2Н2О при увеличении концентрации водорода в 2 раза. V1=K1[H2]2[O2] V2=K2[H2]2[O2] [O2] не изменилось, К – не зависит от концентрации следовательно отношение скорости V2 (с изменением [Н2]) к V1 – начальной скорости, имеет вид:
то есть скорость реакции возрастает в 4 раза.
Решение: в соответствии с правилом Вант – Гоффа.
;
Таким образом, скорость реакции при повышении температуры от 80 до 1200С возрастает в 16 раз, следовательно, для проведения реакции потребуется в 16 раз меньше времени, то есть 1 минута.
Пример 3. Равновесие реакции H2+J2↔2HJ установилось при следующих концентрациях [H2]=0.5 моль/л, [J2]=0.1 моль/л, [HJ]=1.8 моль/л. Определите исходные концентрации йода и водорода и константу химического равновесия. Решение: Из уравнения реакции следует, что к моменту равновесия израсходовано 0,9 моль/л водорода и столько же йода. Следовательно, исходная концентрация водорода составляла 0,5+0,9=1,4 моль/л, а исходная концентрация йода 0,1+0,9=1 моль/л
Пример 4. Эндотермическая реакция разложения пентахлорида фосфора протекает по уравнению: РСl5(г)=РС1з(г)+С12(г); ∆Н = +92,59 кДж. Как надо изменить: а) температуру; б) давление; в) концентрацию, чтобы сместить равновесие в сторону прямой реакции — РС15? Решение. Смещением или сдвигом химического равновесия называют изменение равновесных концентраций реагирующих веществ в результате изменения одного из условий реакции. Направление, в котором сместилось равновесие, определяется по принципу Ле-Шателье: а) так как реакция разложения PC15 эндотермическая (∆H>0), то для смещения равновесия в сторону прямой реакции нужно повысить температуру; б) так как в данной системе разложение РС15 ведет к увеличению объема (из одной молекулы газа образуются две газообразные молекулы), то для смещения равновесия в сторону прямой реакции надо уменьшить давление; в) смещения равновесия в указанном направлении можно достигнуть как увеличением концентрации РСl5, так и уменьшением концентрации РС13 или С12.
Задания для контрольной работы 121. Окисление серы и ее диоксида протекает по уравнениям: а) S(к)+O2=SO2(к); б) 2SO2(r)+O2=2SO3(r). Как изменятся скорости этих реакций, если объемы каждой из систем уменьшить в четыре раза? 122. Напишите выражение для константы равновесия гомогенной системы N2+3H2= 2NH3. Как изменится скорость прямой реакции — образования аммиака, если увеличить концентрацию водорода в три раза? 123. Реакция идет по уравнению N2+ O2=2NO. Концентрации исходных веществ до начала реакций были: [N2] =0,049 моль/л; [O2]=0,01 моль/л. Вычислите концентрацию этих веществ в момент, когда [NO] =0,005 моль/л. Ответ: [N2] =0,0465 моль/л; [О2] =0,0075 моль/л. 124. Реакция идет по уравнению N2+3H2=2NH3. Концентрации участвующих в ней веществ были: [N2]=0,80 моль/л; [Н2] =1,5 моль/л; [NH3]=0,10 моль/л. Вычислите концентрацию водорода и аммиака, когда [N2]= 0,5 моль/л. Ответ: [NH3]=0,70 моль/л; [Н2]=0,60 моль/л. 125. Реакция идет по уравнению H2+J2=2HJ. Константа скорости этой реакции при некоторой температуре равна 0,16. Исходные концентрации реагирующих веществ: [H2] =0,04 моль/л; [J2]=0.05 моль/л. Вычислите начальную скорость реакции и ее скорость, когда [Н2]=0,03 моль/л. Ответ: 3,2*10-4; 1.92 *10-4 126. Вычислите, во сколько раз уменьшится скорость реакции, протекающей в газовой фазе, если понизить температуру от 120 до 80° С. Температурный коэффициент скорости реакции 3. 127. Как изменится скорость реакции, протекающей в газовой фазе, при повышении температуры на 60° С, если температурный коэффициент скорости данной реакции 2? 128. В гомогенной системе CO+ С12=СОС12 равновесные концентрации реагирующих веществ: [СО] =0,2 моль/л; [C12]=O,3 моль/л; [СОСl2] = 1,2 моль/л. Вычислите константу равновесия системы и исходные концентрации хлора и СО. Ответ: К=20; [Сl2]исх=1,5 моль/л; [СО]исх,= 1,4 моль/л. 129. В гомогенной системе А+2В=С равновесные концентрации реагирующих газов: [А] =0,06 моль/л; [В] =0,12 моль/л; [С] =0,216 моль/л. Вычислите константу равновесня системы и исходные концентрации веществ А к В. Ответ: K=2,5; [А]исх=0,276 моль/л; [B]исх=0,552 моль/л. 130. В гомогенной газовой системе A+B=C+D равновесие установилось при концентрациях: [В] =0,05 моль/л и [С] =0,02 моль/л. Константа равновесия системы равна 0,04. Вычислите исходные концентрации веществ А и В. Ответ: [A]исх=0,22 моль/л; [B]исх=0,07 моль/л. 131. Константа скорости реакции разложения N2O, протекающей по уравнению 2N2O=2N2+O2, равна 5-104: Начальная концентрация N2O=6,0 моль/л. Вычислите начальную скорость реакции и ее скорость, когда разложится 50% N2O. Ответ: 1,8-10~2; 4,5-10~3. 132. Напишите выражение для константы равновесия гетерогенной системы СО2+С=2СО. Как изменится скорость прямой реакции — образования СО, если концентрация СО2 уменьшится в 4 раза? Как следует изменить давление, чтобы повысить выход СО? 133. Напишите выражение для константы равновесия гетерогенной системы С+Н2О(г)=СО+Н2. Как следует изменить концентрацию и давление, чтобы сместить равновесие в сторону обратной реакции — образования водяных паров?
134. Равновесие гомогенной системы: 4НС1 (г)+О2=2Н2О (г) +2С12 (г) установилось при следующих концентрациях реагирующих веществ [H2O]p =0,14 моль/л; [С12]р=0,14 моль/л; [НС1]Р=0,20 моль/л; [О2]р=0,32 моль/л. Вычислите исходные концентрации хлороводорода и кислорода. Ответ: [HCl]исх =0,48 моль/л; [О2]Исх=0,39 моль/л. 135. Вычислите константу равновесия для гомогенной системы: СО(г)+Н2О(г)=СО2(г)+Н2(г). если равновесные концентрации реагирующих веществ: [CO]p=0,004 моль/л; [H2O]P=0,064 моль/л; [СО2]Р= 0,016 моль/л; [H2]Р=0,016 моль/л. Чему равны исходные концентрации воды и СО? Ответ: K=l; [H2O]исх =0,08 моль/л; [CO]исх=0,02 моль/л. 136. Константа равновесия гомогенной системы: СО (г) +H2O(r)=CO2+ Н2(г) при некоторой температуре равна 1. Вычислите равновесные концентрации всех реагирующих веществ, &ли исходные концентрации: [СО]исх=0,10 моль/л; [Н2О]исх=0,40 моль/л. Ответ: [СО2]р=[Н2]р = 0,08 моль/л; [Н2О]Р=0.32 моль/л; [СО]р=0.02 моль/л. 137. Константа равновесия гомогенной системы N2+3H2=2NH3 при некоторой температуре равна 0,1. Равновесные концентрации водорода и аммиака соответственно равны 0,2 и 0,08 моль/л. Вычислите равновесную и исходную концентрацию азота. Ответ: [N2]P=8 моль/л; [N2]исх=8,04 моль/л. 138. При некоторой температуре равновесие гомогенной системы 2NO+O2=2NO2 установилось при следующих концентрациях реагирующих веществ: [NO]p=0,2 моль/л; [О2]р=0,1 моль/л; [NO2]p=0,l моль/л. Вычислите константу равновесия и исходную концентрацию NО и О2. Ответ: К=2.5; [NO]ИСХ=0,3 моль/л; [O2]ИСХ=0,15 моль/л. 139. Почему при изменении давления смещается равновесие системы N2+3H2=2NH3 и не смещается равновесие системы N2+O2=2NO? Ответ мотивируйте на основании расчета скорости и обратной реакции в этих системах до и после изменения давления. Напишите выражения для констант равновесия каждой из данных систем. 140. Исходные концентрации [NO]исх и [Сl2]исх в гомогенной системе 2NO+CI2=2NOCl составляют соответственно 0,5 и 0,2 моль/л. Вычислите константу равновесия, если к моменту наступления равновесия прореагировало 20% NO. Ответ: 0,416.
КОЛЛОИДНЫЕ РАСТВОРЫ. 8.1.Коллоидные растворы – гетерогенные системы, состоящие из двух фаз, между которыми имеется поверхность раздела, самопроизвольно не возникают, требуют затраты энергии. Дисперсные системы.
Коллоидные растворы образуют систему, в которой вещество называется дисперсной фазой, а среда (растворитель) – дисперсной средой.
Существуют два способа получения коллоидных растворов: Дисперсионный – метод дробления крупных частиц на мелкие. Конденсационный (химический) – метод укрупнения частиц. Способ называется химическим, так как в основе его лежат химические реакции: гидролиза, обмена, окислительно-восстановительные, пептизации.
8.2.Пример: Золь иодида серебра получают реакцией обмена между нитратом серебра и иодидом калия: AgNO3+KJ®AgJ¯+KNO3. По названию золя судят о составе ядра. Ядро образовано молекулами малодиссоциированного соединения AgJ. Поверхность ядра сорбирует частицы, по химической природе близкие к ядру и в реакции взятые в избытке. Например, в избытке AgNO3, ядро адсорбирует ионы Ag+. Ионы противоположного знака, это ионы NO3– – формируют слой противоионов. И они же образуют диффузный слой, то есть в целом мицелла становится электронейтральной.
Формула мицеллы золя иодида серебра: {[mAgJ]*nAg+*(n-x) NO3–}*xNO3– где n, m,(n-x), x – число частиц nAg+ – адсорбационный слой (n-x) NO3– – слой противоионов
NO3– NO3–
Ag+
AgJ
Схема строения мицеллы золя йодида серебра.
Коагуляция – слипание частиц коллоидной системы при их столкновениях в процессе теплового (броуновского) движения, перемешивания или направленного перемещения во внешнем силовом поле. В результате коагуляции образуются агрегаты – более крупные (вторичные) частицы, состоящие из скопления более мелких (первичных). Первичные частицы в таких скоплениях соединены силами межмолекулярного взаимодействия непосредственно или через прослойку окружающей (дисперсионной) среды. Коагуляция сопровождается прогрессирующим укрупнением частиц (увеличением размера и массы агрегатов) и уменьшением их числа в объеме дисперсионной среды – жидкости или газа. Коагуляция наступает в результате проявления сил тяжести. Достигнув известной величины, частицы становятся уже неспособными удерживаться во взвешенном состоянии и выделяются из той среды, в которой они были распределены Важнейшим фактором, противодействующим коагуляции, является наличие на коллоидных частицах электрических зарядов. Вследствие одноименности последних движущимся навстречу друг другу частицам лишь в крайне редких случаях удается сойтись настолько близко, чтобы между ними могли достаточно эффективно проявиться силы стяжения. В результате содержащий сильно заряженные коллоидные частицы золь заметно не коагулирует даже при долгом хранении, то есть является весьма устойчивым. Очевидно, что снятие с коллоидных частиц их электрического заряда (хотя бы частичное) должно понижать устойчивость золей и способствовать их коагуляции. Такое разряжение в случае гидрозолей может быть проще всего достигнуто добавлением к коллоидному раствору электролитов. Хотя при этом вводится одинаковое число положительных и отрицательных зарядов, но в непосредственно окружающей коллоидную частицу «ионной атмосфере» всегда несколько преобладают ионы, противоположна ей заряженные, которые частицей преимущественно и адсорбируются. Так как введение электролита сильно повышает общую концентрацию ионов в растворе, условия для их адсорбции становятся весьма благоприятными и первоначальный заряд частиц быстро нейтрализуется, следствием чего является коагуляция золя.
Ионы, имеющие заряд противоположный по знаку противоионному слою коллоидной частицы, способны усиливать коагуляцию раствора, причем этот эффект будет увеличиваться при увеличении заряда иона-коагулянта. Задания для контрольной работы. Напишите возможные варианты строения мицелл, полученных методом обменного разложения (образуется средняя соль). Укажите ион-коагулянт.
РАСТВОРЫ 9.1. Раствор твердая или жидкая гомогенная система, состоящая из двух или более компонентов (составных частей), относительные количества которых могут изменяться в широких пределах. Наиболее важные жидкие растворы. Раствор состоит из растворителя и растворенного вещества. Растворитель-компонент, который в чистом виде существует в таком же агрегатном состоянии, что и полученный раствор. Если оба компонента до растворения находились в одинаковом агрегатном состоянии (спирт и вода), то растворителем считается компонент, находящимся в большем количестве. Системы с размером частиц менее 1 нм образуют истинные растворы. Они состоят из молекул, атомов или ионов растворëнного вещества, их следует рассматривать как однофазные системы. Такие системы называются гомогенными, внутри них отсутствуют поверхности раздела - все части однородны по составу и свойствам. В сельскохозяйственной практике пользуются растворами для борьбы с вредителями и болезнями растений и животных, для протравливания семян, для борьбы с сорняками и т.д. Поэтому специалисты сельского хозяйства, должны быть хорошо знакомы со свойствами растворов и уметь приготавливать растворы разного назначения. В химической практике используются различные способы количественного выражения состава раствора. Сходства растворов с химическими веществами: 1)однородность 2)выделение теплоты при растворении Отличия растворов от химических веществ: 1)состав раствора может изменяться в разных пределах. 2)в свойствах раствора можно обнаружить многие свойства его отдельных компонентов. Растворы занимают промежуточное положение между химическими соединениями и механическими смесями. Насыщенный раствор - раствор, находящийся в равновесии с растворяющемся веществом. Ненасыщенный раствор-раствор с меньшей концентрацией растворенного вещества, чем в насыщенном растворе. Концентрация раствора - это кол-во растворенного вещества, содержащегося определенном количестве раствора или растворителя. Концентрированные растворы - растворы с относительно высоким содержанием растворенного вещества. Разбавленные растворы - растворы с относительно низким содержанием растворенного вещества.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2020-12-09; просмотров: 126; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.224.149.242 (0.073 с.) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
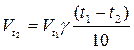 При повышении температуры на 100С скорость реакции возрастает в 2-4 раза.
При повышении температуры на 100С скорость реакции возрастает в 2-4 раза. температурный коэффициент.
температурный коэффициент.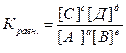
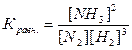
 Прямая реакция экзотермическая
Прямая реакция экзотермическая Обратная реакция эндотермическая
Обратная реакция эндотермическая
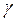 Пример2. При 800С некоторая реакция заканчивается за 16 минут. Сколько потребуется времени для проведения той же реакции при 1200С. Температурный коэффициент реакции =2.
Пример2. При 800С некоторая реакция заканчивается за 16 минут. Сколько потребуется времени для проведения той же реакции при 1200С. Температурный коэффициент реакции =2.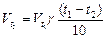
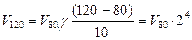
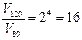 отсюда
отсюда


 xNO3– – диффузный слой.
xNO3– – диффузный слой.


