
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Кислоты. Классификация. Свойства. Получение.Содержание книги
Поиск на нашем сайте
Кислоты сложные вещества, содержащие один, или несколько атомов водорода, способных полностью, или частично замещаться на атом металла. В растворах кислоты имеют рН менее 7. Индикатор лакмус изменяет окраску на красный; фенолфталеин - бесцветный; метилоранжевый - на розовый.
Существует несколько классификаций кислот:
КИСЛОТЫ ↓ ↓ Бескислородные Кислородосодержащие HI, HBr, H2S. H2SO3, HClO2
КИСЛОТЫ ↓ ↓ ↓ Одноосновные Двухосновные Многоосновные HCl, HNO3 H2S, H2SO4 H3PO4
НОМЕНКЛАТУРА: Многие кислоты сохранили историческое название, например, соляная кислота HCl, плавиковая кислота HF. Название кислородных кислот происходит от названия неметалла с добавлением –ная- и -вая-, если степень окисления неметалла максимальная:
+6 H2SO4 –максимальное - серная кислота +5 H3AsO4 – максимальное - мышьяковая кислота
По мере понижения степени окисления суффикс меняется в следующем порядке –оватая-, -истая-, -оватистая-.
+7 HClO4 – хлорная +5 HClO3 - хлорноватая +3 HClO2 - хлористая +1 HClO – хлорноватистая
ПОЛУЧЕНИЕ 1) Бескислородные кислоты: получают методом прямого синтеза. Cl2 + H2→2HCl 2) Действием более сильных кислот на соответствующие соли FeS+2HCl→ H2S↑+FeCl2 3) Взаимодействие кислотных оксидов и воды SO3+ H2O→H2SO4
ХИМИЧЕСКИЕ СВОЙСТВА. 1) Взаимодействие кислот с активными металлами HCl+Zn→ZCl2+H2↑ 2) C основными оксидами H2SO4+CaO→CaSO4+H2O 3) Взаимодействие кислот с основаниями H3PO4+3NaOH→Na3PO4+3H2O 4) Взаимодействие кислот с амфотерными оксидами
6HCl+Al2O3→2AlCl3+3H2O 5) Взаимодействие кислот с солями H2SO4+BaCl2→BaSO4↓+HCl – реакция возможна, если продукт выделяется газом, или выпадает в осадок.
Основания. Основания – это сложные вещества, состоящие из атомов металла и одой или нескольких гидроксильных групп. Названия образуют с помощью слова <гидроксид>, к которому добавляется название металла в родительном падеже. Для гидроксидов металлов с переменной валентностью ее следует указать.
Соли. Соли – продукт полного или частичного замещения атомов водорода в молекуле кислоты на металл или же продукт полного или частичного замещения группы ОН- в основании на кислотный остаток.
Соли: 1) Средние (NaCl, Na2SO4, Fe3(PO4)2). 2) Кислые (NaHCO3, Ca(HSO4)2, Fe(HPO4)3 ). 3) Основные (FeOHCl, (CaOH)2SO4). 4) Двойные (CaCO3* MgCO3). 5) Смешанные (Na3CO3(HCO3)). 6) Комплексные (K4[Fe(CN)6]).
Номенклатура: 1) средние соли кислотный остаток + название Ме (валентность Ме). Fe2(SO4)3 Сульфат железа (III) 2) кислые соли гидро + кислотный остаток + название Ме (валентность Ме). NaHSO4 – гидросульфат Na. Fe(H2PO4)2 – дигидрофостфат Fe(II). 3) основные соли кислотный остаток + гидроксо + Ме (валентность Ме). CaOHCl Хлорид гидроксокальция (Al(OH)2)2SO4 сульфат дигидроксоалюминия 4) двойные соли кислотный остаток + Ме + Ме KAl(SO4)2 – сульфаталлюминия-калия 5) смешанные соли Na3CO3(HCO3) – гидрокарбонат-карбонат натрия 6) комплексные соли K4[Fe(CN)6] – гексоцианоферрат(III) калия
Получение: 1) метод прямого синтеза Mg + Cl2 → MgCl2 2) активный Ме + кислота Mg + 2HCl → MgCl2 + H2↑ 3) малоактивный Ме с концентрированными кислотами (H2SO4 + HNO3). Cu + H2SO4 (k) → CaSO4 + SO2↑+ H2O 4) основной оксид + кислота CaO + 2HCl → CaCl2 + H2O 5) основание + кислота Ca(OH)2 + HCl → CaCl2 + H2O 6) основной оксид + кислотный оксид CaO + CO2 → CaCO3 7) основание + кислотный оксид Ca(OH)2 + CO2 → CaCO3 + H2O 8) основание + кислота Ca(OH)2 + H2SO4 → CaSO4 + 2H2O 9) соль + кислота Na2SiO3 + HCl → NaCl + H2SiO3↓ 10) соль + основание CuSO4 + 2NaOH→ Cu(OH)2↓ + Na2SO4 11) соль + соль AgNO3 + NaCl → AgCl↓ + NaNO3
Химические свойства: Соли взаимодействуют с Ме, кислотами, основаниями и между собой (уравнения реакций смотрите выше). При нагревании соли аммония, малоактивных Ме, слабых кислот и кислот, в которых элементы проявляют максимальную валентность, разлагаются.
NH4Cl → NH3↑ + HCl Хлорид аммония AgNO3 → Ag + O2 + NO2 CaCO3 → CaO + CO2↑ KNO3 → KNO2 + O2
Генетическая связь основных классов неорганических соединений. −−−−−−−−Элементы −−−−−−−−−− ↓ ↓ ↓ Ме амфотерные элементы неМе ↓ ↓ ↓ осн.оксиды амфотерные оксиды кислот.оксиды ↓ ↓ ↓ основания амфотерные гидроксиды кислоты ↓ ↓ ↓ соли Задания для контрольной работы. 2.6.1. Запишите молекулярные формулы химических соединений и укажите число элементов, входящих в состав молекулы, количество атомов в молекуле. Таблица 2.6.1
Таблица 2.6.2..Записать уравнения химических превращений, назвать согласно номенклатуре ИЮПАК все вещества.
3. ОСНОВНЫЕ ЗАКОНЫ ОБЩЕЙ ХИМИИ. СТЕХИОМЕТРИЯ.
3.1 Стехиометрия — раздел химии, в котором рассматриваются массовые или объемные соотношения между реагирующими веществами. Исключительное значение для развития химии имеют следующие стехиометрические законы. 1.Закон постоянства состава. Соотношение масс элементов, формирующих данное соединение, постоянно и не зависит от способа получения этого соединения. 2.Закон кратных отношений. Установлен Дальтоном в 1803г. В случае, когда два элемента образуют между собой несколько химических соединений, массы элементов относятся друг к другу как небольшие целые числа.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2020-12-09; просмотров: 93; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.133.147.193 (0.007 с.) |

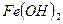 - гидроксид железа (II)
- гидроксид железа (II)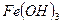 - гидроксид железа (III)
- гидроксид железа (III)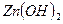 - гидроксид цинка
- гидроксид цинка


