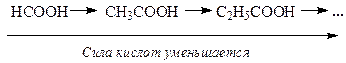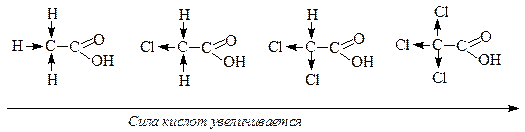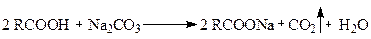Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Одноосновные карбоновые кислотыСодержание книги
Поиск на нашем сайте
Одноосновные карбоновые кислоты – производные углеводородов, получаемые путем замещения атома водорода на карбоксильную группу –СООН.
Общая формула: СnH2n+1COOH ( n ≥ 0) или CnH2nO2 (n ≥ 1)
Гомологический ряд, изомерия, номенклатура НСООН - метановая (муравьиная) кислота СН3СООН – этановая (уксусная) кислота
СН3СН2СООН – пропановая (пропионовая) кислота
- 2-метилпропановая (изомасляная) кислота
Одноосновные карбоновые кислоты изомерны другому классу соединений – сложным эфирам
Способы получения a) окисление спиртов и альдегидов Последовательное окисления первичных спиртов и альдегидов приводит к получению карбоновых кислот. Общую схему превращений можно представить следующим образом:
b) щелочной гидролиз трихлорпроизводный углеводородов
c) гидролиз нитрилов карбоновых кислот
d) окислительное расщепление кратных связей в алкенах и алкинах
Физические свойства
Температуры кипения кислот значительно выше температур кипения спиртов и альдегидов с тем же числом атомов углерода, что объясняется образованием циклических и линейных ассоциатов между молекулами кислот за счет водородных связей.
Химические свойства Электронное строение молекул карбоновых кислот
карбоксилат-ион В карбоксилат-ионе имеет место р,π-сопряжение неподеленной пары электронов атома кислорода гидроксильной группы с р -облаками, образующими π-связь, в результате происходит делокализация π-связи и раномерное распределение отрицательного заряда между двумя атомами кислорода:
Если в состав карбоновой кислоты входит атом или группа атомов, являющиеся акцепторами электронной плотности, то в этом случае происходит перераспределение электронной плотности в молекуле кислоты, и при этом увеличивается сила кислот, так как связь О—Н становится более поляризованной.
Реакции по карбоксильной группе I. Кислотные свойства a) реакция нейтрализации Карбоновые кислоты с основаниями вступают в реакцию нейтрализации, протекающую с образованием солей и воды:
b) реакция с основными оксидами Карбоновые кислоты, взаимодействуя с основными оксидами, образуют соли.
c) реакция с металлами Активные металлы взаимодействуют с карбоновыми кислотами с образованием солей и выделением водорода:
d) реакция с солями Карбоновые кислоты взаимодействуют с солями более слабых кислот (в т.ч. с карбонатами и гидрокарбонатами) с образованием солей:
E) реакция с аммиаком Карбоновые кислоты, взаимодействуя с аммиаком, образуют соли аммония.
II. Замещение группы – ОН a) взаимодействие со спиртами При рассмотрении химических свойств спиртов мы уже обсуждали реакцию этерификации, протекающую между карбоновыми кислотами и спиртами с образованием сложных эфиров и воды. Следует подчеркнуть, что вода образуется за счет взаимодействия функциональных групп: карбоксильной (карбоновые кислоты) и гидроксильной (спирты). При этом от карбоксильной группы отщепляется группа – ОН, а от молекулы спирта – атом водорода.
b) взаимодействие с NH3 При нагревании карбоновые кислоты реагируют с аммиаком с образованием амидов кислот. Схема данной реакции протекает аналогично вышеуказанной: от карбоксильной группы отщепляется группа – ОН, а от молекулы аммиака – атом водорода.
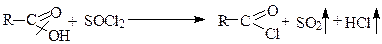
c) образование галогенангидридов Наибольшее значение имеют хлорангидриды. Хлорирующими агентами выступают – РCl3, PCl5 и тионилхлорид SOCl2.
d) образование ангидридов кислот Реакция образования ангидридов кислот – это реакция межмолекулярной дегидратации, протекающая между молекулами карбоновых кислот с отщеплением воды.
|
|||||
|
Последнее изменение этой страницы: 2017-02-22; просмотров: 291; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.118.0.158 (0.005 с.) |

 - бутановая (масляная)кислота
- бутановая (масляная)кислота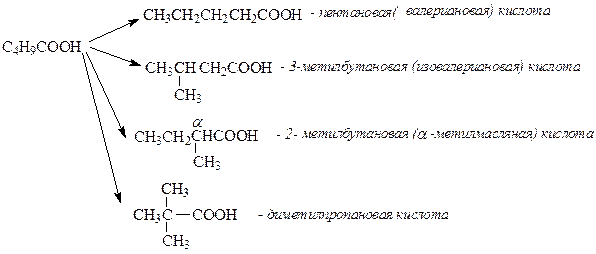





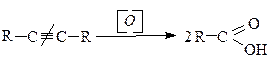
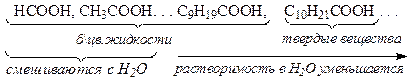

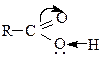 Показанное в формуле смещение электронной плотности в сторону карбонильного атома кислорода обусловливает сильную поляризацию связи О—Н, в результате чего облегчается отрыв атома водорода в виде протона – в водных растворах происходит процесс кислотной диссоциации:
Показанное в формуле смещение электронной плотности в сторону карбонильного атома кислорода обусловливает сильную поляризацию связи О—Н, в результате чего облегчается отрыв атома водорода в виде протона – в водных растворах происходит процесс кислотной диссоциации: