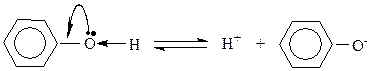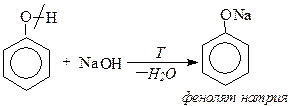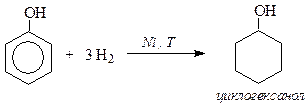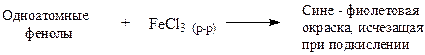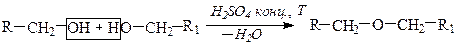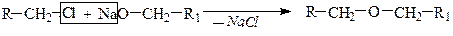Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Электронное строение молекулы фенола. Взаимное влияние атомов в молекулеСодержание книги
Поиск на нашем сайте
Фенолы вступают в реакции, характерные как для спиртов, так и для ароматических углеводородов, причем реакции галогенирования, нитрования и сульфирования идут более энергично, чем в случае ароматических углеводородов.
I.Реакции с участием гидроксильной группы (кислотные свойства) a) взаимодействие с активными металлами Фенолы, выступая в роли кислот, взаимодействуют с металлами с образованием фенолятов и водорода:
b) взаимодействие со щелочами Реакция нейтрализации фенолов со щелочами протекает с образованием фенолятов и воды. Эта реакция используется для отличия фенолов от спиртов.
Фенол – очень слабая кислота, поэтому феноляты разлагаются не только сильными кислотами, но даже такой слабой кислотой, как угольная.
II. Реакции с участием гидроксильной группы (образование сложных и простых эфиров) Как и спирты фенолы могут образовывать простые и сложные эфиры.
a) получение сложных эфиров
Сложные эфиры образуются при взаимодействии фенолов с ангидридами или хлорангидридами карбоновых кислот. Реакция прямой этерификации карбоновых кислот протекает труднее.
b) получение простых эфиров Простые эфиры (алкилариловые) образуются при взаимодействии фенолятов с алкилгалогенидами:
III. Реакции замещения с участием бензольного кольца a) обесцвечивание бромной воды Реакцию бромирования фенола, протекающую с образованием белого осадка трибромфенола, иногда рассматривают как качественную реакцию обнаружения фенола.
b) нитрование разбавленной азотной кислотой Реакция нитрования фенола разбавленной азотной кислотой происходит с образованием смеси мононитропроизводных фенола.
c) нитрование концентрированной азотной кислотой В реакции нитрования фенола концентрированной азотной кислотой в бензольное кольцо входит три нитрогруппы и образуется пикриновая кислота.
d) сульфирование В зависимости от условий проведения реакции сульфирования фенола образуются различные изомеры гидроксибензолсульфокислот.
IV. Реакции присоединения (гидрирование)
Каталитическое гидрирование фенола приводит к получению алициклического спирта - циклогексанола
V. Качественная реакция с хлоридом железа (III)
VI. Реакции окисления
Фенолы легко окисляются даже под действием кислорода воздуха. При стоянии на воздухе фенол постепенно окрашивается в розовато-красный цвет за счет окисления до гидрохинона. При энергичном окислении фенола хромовой смесью основным продуктом окисления является хинон.
Простые эфиры Общая формула простых эфиров R—O—R1. По рациональной номенклатуре названия простых эфиров строят по названию углеводородных радикалов, связанных с атомом кислорода.
Изомерия простых эфиров определяется изомерией углеводородных радикалов.
Простые эфиры являются изомерами одноатомных спиртов.
Способы получения Простые эфиры получают по реакции межмолекулярной дегидратацией спиртов или взаимодействием алкоголятов и галогенводородов (синтез Вильямсона).
1) Межмолекулярная дегидратация спиртов Реакция межмолекулярной дегидратации спиртов протекает в присутствии водоотнимающего средства - концентрированной серной кислоты. Присутствие H2SO4 необходимо для смещения равновесия реакции в сторону получения простого эфира.
2) Ситез Вильямсона.
Химические свойства Простые эфиры – это малореакционные соединения, разлагающиеся под действием концентрированной йодоводородной кислоты. В результате образуются спирты и йодсодержащие углеводороды.
При избытке йодоводородной кислоты образовавшиеся вещества восстанавливаются до углеводородов.
Вопросы для самоконтроля
|
||||
|
Последнее изменение этой страницы: 2017-02-22; просмотров: 599; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.146.178.220 (0.007 с.) |

 Гидроксильная группа – ОН (как и алкильные радикалы) является заместителем I рода, т.е. электродонором. Это обусловлено тем, что одна из неподеленных электронных пар гидроксильного атома кислорода вступает в р-,π- сопряжение с π-системой бензольного кольца. В результате этого взаимодействия наблюдается: во-первых, повышение электронной плотности на атомах углерода в орто - и пара -положениях бензольного кольца, что облегчает замещение атомов водорода в этих положениях; во-вторых, увеличение полярности связи О—Н приводит к диссоциации фенола в растворах, что в свою очередь приводит к усилению кислотных свойств фенолов по сравнению со спиртами. Фенолы являются слабыми кислотами, диссоциируют с образованием катиона водорода и фенолят аниона:
Гидроксильная группа – ОН (как и алкильные радикалы) является заместителем I рода, т.е. электродонором. Это обусловлено тем, что одна из неподеленных электронных пар гидроксильного атома кислорода вступает в р-,π- сопряжение с π-системой бензольного кольца. В результате этого взаимодействия наблюдается: во-первых, повышение электронной плотности на атомах углерода в орто - и пара -положениях бензольного кольца, что облегчает замещение атомов водорода в этих положениях; во-вторых, увеличение полярности связи О—Н приводит к диссоциации фенола в растворах, что в свою очередь приводит к усилению кислотных свойств фенолов по сравнению со спиртами. Фенолы являются слабыми кислотами, диссоциируют с образованием катиона водорода и фенолят аниона: