
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Кислородсодержащие органические соединенияСодержание книги
Поиск на нашем сайте
Кислородсодержащие органические соединения
Издательский центр МГУИЭ
МИНОБРНАУКИ РОССИИ
Факультет экологии и природопользования Кафедра «Физическая химия»
КИСЛОРОДСОДЕРЖАЩИЕ ОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ .
Методическое пособие
Москва МГМУ Учебное издание
Составители: Афонина Людмила Петровна Беспалов Гелий Николаевич Исаева Галина Сергеевна Стрельцова Елена Дмитриевна
Кислородсодержащие органические соединения Редактор В.И. Лузева
Формат бум. 60 x 84 1/16. Объем усл. п. л. 5,0. Уч.-изд. л. 4,0. Тираж 500 экз. Зак. МГМУ, издательский центр, 105066 Москва, Старая Басманная ул., 21/4 Отпечатано на предприятии ООО «Промгрупп»
В настоящем пособии рассматриваются следующие классы кислородсодержащих органических соединений: спирты, фенолы, альдегиды и кетоны, карбоновые кислоты и их производные.
Спирты Спиртами называются производные углеводородов, в которых один или несколько атомов водорода заменены на гидроксильные группы (оксигруппы) – ОН. Номенклатура В названии спиртов широкое распространение получила тривиальная номенклатура спиртов, в соответствии с которой название производится от углеводородного радикала в сочетании со словом «спирт». Использование такого принципа построения названия спиртов возможно в случаях несложных радикалов. По рациональной номенклатуре более сложные по строению спирты можно рассматривать как производные метилового спирта – карбинола. При построении названия спиртов в соответствии с номенклатурой ИЮПАК к названию углеводорода с самой длинной цепью, включающей гидроксильную группу, добавляется суффикс ол и цифра, обозначающая номер атома углерода, с которым связана гидроксильная группа. Нумерацию цепи начинают с того конца, ближе к которому расположена функциональная группа. При названии многотомных спиртов используют умножающие приставки ди-, три- и т.д.
Классификация спиртов: 1. по атомности, т.е. по числу гидроксильных групп в молекуле, различают: · одноатомные спирты (алкоголи R-OH)
· двухатомные спирты (гликоли, диолы R(OH)2)
· трехатомные спирты (триолы R(OH)3)
Двух-,трех- и т.д. спирты называтся многоатомнами.
2. по строению углеводородного радикала различают: · алифатические предельные и непредельные:
· циклические:
· ароматические:
3. по принадлежности функциональной группы к атому углерода различают:
Предельные одноатомные спирты Сn H2n+1OH ( n≥1 ) Гомологический ряд
Изомерия Изомерия спиртов обусловлена строением углеводородного радикала (изомерия углеродного скелета) и положением функциональной группы. изомерия цепи
изомерия положения функциональной группы
Предельные одноатомные спирты изомерны другому классу кислородсодержащих углеводородов– простым эфирам R-O-R1
Способы получения спиртов
1. Каталитическая гидратация алкенов Реакциягидратацииалкенов происходит в присутствии катализатора серной кислоты. Присоединение молекулы воды по месту разрыва кратной связи происходит в соответствии с правилом Марковникова.
2. Щелочной гидролиз галогеналканов
3. Гидрирование альдегидов и кетонов В реакции гидрирования альдегидов образуются первичные спирты.
Вторичные спирты образуются при гидрировании кетонов.
Гидрирование карбонильных соединений является реакцией восстановления.
4. Гидролиз сложных эфиров (кислотный и щелочной) Реакция гидролиза сложных эфиров, протекающая в кислой среде, является обратимой.
Необратимый гидролиз сложных эфиров происходит в щелочной среде.
Специфические способы получения СН3ОН и С2Н5ОН Синтез из водяного газа
Спиртовое брожение глюкозы
Физические свойства
Первые десять членов гомологического ряда предельных одноатомных спиртов являются жидкостями, высшие спирты – твердые вещества. По сравнению с соответствующими углеводородами, спирты обладают аномально высокими значениями Ткип по сравнению. Это объясняется ассоциацией молекул спиртов вследствие образования межмолекулярных водородных связей.
Все предельные одноатомные спирты легче воды, бесцветны. Метанол, этанол, пропанол неограниченно растворяются в воде; с увеличением числа атомов углерода растворимость спиртов уменьшается.
Химические свойства
Функциональная группа спиртов - гидроксил – обуславливает химические свойства этого класса кислородсодержащих углеводородов. Молекулы спиртов содержат полярные связи С – О и О – Н. На атоме водорода и углерода имеется дефицит электронной плотности, а на атоме кислорода – избыток электронной плотности. Такой электронный характер гидроксильной группы предполагает ее склонность к реакциям разрыва либо связи С – О, либо связи О – Н. Тем не менее, в водных растворах диссоциация О – Н связи не происходит. Спирты не являются электролитами. Водные растворы спиртов не изменяют цвет индикаторов.
Реакции замещения
1) Взаимодействие с активными металлами При реакции спиртов с металлами происходит замещение атома водорода в группе –ОН атомами металлов (образуются алкоголяты):
Алкоголяты подвергаются необратимому гидролизу, что в свою очередь доказывает - спирты не проявляют кислотные свойства (точнее являются более слабыми кислотами по сравнению с водой).
2) Реакция этерификации При взаимодействии спиртов с карбоновыми кислотами образуются сложные эфиры.
3) Замещение гидроксильной группы на атом гелогена Спирты обратимо реагируют с галогеноводородными кислотами (HHal) с образованием галогеналканов.
Спирты можно превратить в галогеналканы также действием галогенидов фосфора.
4) Замещение гидроксильной группы на аминогруппу Спирты взаимодействуют с аммиаком с образованием аминов. В случае протекания реакции в присутствии избытка спирта возможно образование наряду с первичными аминами вторичных и третичных аминов.
Реакции окисления Спирты окисляются легче, чем углеводороды, причем в первую очередь окислению подвергается углерод, при котором находится гидроксильная группа. Первичные и вторичные спирты окисляются легче третичных, что обусловлено наличием водорода при атоме углерода, связанном с гидроксилом. Третичные спирты окисляются в более жестких условиях с разрушением углеродного скелета. 1) Окисление первичных спиртов Неполное окисление первичных спиртов различными окислителями приводит к образованию альдегидов.
2) Окисление вторичных спиртов Неполное окисление вторичных спиртов различными окислителями приводит к образованию кетонов.
3) Окисление третичных спиртов В результате реакции окисления третичных спиртов окислителями происходит разрушение углеродного скелета, рвется связь С – С. Разрыв происходит между атомом углерода, связанным с гидроксильной группой, и соседним углеродным атомом. Если концевой атом углерода является вторичным, то при окислении этот углерод входит в карбоксильную группу. Если концевой атом углерода - третичный, то при окислении этот углерод войдет в состав карбонильной группы. Таким образом, продуктами реакции окисления третичных спиртов являются карбоновые кислоты (муравьиная кислота окисляется до СО2) и кетоны.
По продуктам окисления возможно установление структуры третичного спирта. Например, известно, что при окислении третичного спирта были получены углекислый газ, уксусная и 2-метилбутановая кислоты, метилэтилкетон. Необходимо установить структуру исходного спирта, учитывая возможные варианты разрушения углеродного скелета.
Получение гликолей
1) Окисления алкенов перманганатом калия в нейтральной среде (реакция Вагнера):
2) Щелочной гидролиз дигалогеналканов:
Получение глицерина
1) Кислотный гидролиз жиров – обратимая реакция, протекающая с образованием глицерина и карбоновых кислот:
2) Щелочной гидролиз жиров: - необратимая реакция, протекающая с образованием глицерина и солей карбоновых кислот:
Фенолы
Фенолы – это производные ароматических УВ, в которых одна или несколько гидроксильных групп непосредственно связаны с бензольным кольцом.
Номенклатура Названия фенолов составляют с учетом того, что для номенклатуры ИЮПАК сохранено тривиальное название «фенол». Нумерация атомов углерода бензольного кольца начинают с атома, непосредственно связанного с гидроксильной группой, и продолжают в такой последовательности, чтобы имеющиеся заместители получили наименьшие номера. Классификация
По числу гидроксильных групп фенолы классифицируют на:
Физические свойства
Простейшие фенолы при комнатных температурах представляют собой низкоплавкие бесцветные кристаллические вещества с характерным запахом. Фенолы малорастворимы в воде, но хорошо растворяются в органических растворителях. Фнолы образуют прочные водородные связи и имеют довольно высокие температуры кипения и плавления. Являются токсичными веществами, вызывают ожоги кожи.
Способы получения 1) Сплавление солей ароматических сульфокислот со щелочами При сплавлении натриевой соли ароматической сульфокислоты со щелочью сначала образуется фенолят, который при дальнейшем взаимодействии с кислотой превращается в фенол.
2) Щелочной гидролиз арилгалогенидов При нагревании хлорбензола и гидроксида натрия под давлением получают фенолят натрия, при дальнейшей обработке которого кислотой образуется фенол:
3) Кумольный способ На первой стадии из бензола получают кумол (изопропилбензол), каталитическое окисление которого кислородом приводит к получению гидропероксида кумола. Дальнейшее нагревание гидропероксида кумола с серной кислотой приводит к получению фенола и ацетона, которые разделяют путем ректификакции (фракционной перегонки). Это основной промышленный способ получения фенола:
Химические свойства Простые эфиры Общая формула простых эфиров R—O—R1. По рациональной номенклатуре названия простых эфиров строят по названию углеводородных радикалов, связанных с атомом кислорода.
Изомерия простых эфиров определяется изомерией углеводородных радикалов.
Простые эфиры являются изомерами одноатомных спиртов.
Способы получения Простые эфиры получают по реакции межмолекулярной дегидратацией спиртов или взаимодействием алкоголятов и галогенводородов (синтез Вильямсона).
1) Межмолекулярная дегидратация спиртов Реакция межмолекулярной дегидратации спиртов протекает в присутствии водоотнимающего средства - концентрированной серной кислоты. Присутствие H2SO4 необходимо для смещения равновесия реакции в сторону получения простого эфира.
2) Ситез Вильямсона.
Химические свойства Простые эфиры – это малореакционные соединения, разлагающиеся под действием концентрированной йодоводородной кислоты. В результате образуются спирты и йодсодержащие углеводороды.
При избытке йодоводородной кислоты образовавшиеся вещества восстанавливаются до углеводородов.
Вопросы для самоконтроля Вариант 1.16 1. Составьте структурные формулы спиртов, имеющих состав С4Н10О. Назовите их. 2. Дайте названия следующим соединениям:
3. Получите диэтиловый эфир двумя способами. 4. Из пропанол-1 через непредельный углеводород получите пропанол-2. 5. Напишите уравнение реакции окисления этилового спирта до уксусного альдегида бихроматом калия в кислой среде. Вариант 2.17 1. Составьте структурные формулы простых эфиров, имеющих состав С4Н10О, и дайте им названия. 2. Назовите следующие соединения:
К какому классу органических соединений они относятся? 3. Какие соединения образуются при действии на метиловый эфир йодистоводородной кислоты? 4. Напишите уравнения реакций пропилового спирта со следующими веществами: а) металлическим кальцием, б) пятихлористым фосфором, в) Концентрированной серной кислотой с последующим нагревом образовавшегося соединения. 5. Напишите уравнение реакции окисления н. бутилового спирта бихроматом калия в кислой среде, если продуктом окисления является масляная кислота CH3CH2CH2COOH.
Вариант 3.18 1. Составьте структурные формулы двухатомных спиртов, имеющих состав С4Н10О2, и дайте им названия. 2. Назовите следующие соединения всеми возможными способами:
3. Из пропилового спирта через стадию образования галогенопроизводного получите диизопропилвый эфир. 4. Из бензола получите п-крезол. 5. Напишите уравнение реакции окисления изопропилового спирта бихроматом калия в кислой среде.
Вариант 4.19 1. Составьте структурные формулы всех изомеров (спиртов и простых эфиров), имеющих состав С3Н8О, и дайте им названия. 2. Назовите следующие соединения:
3. При взаимодействии с каким простым эфиром образуется смесь йодистого этила и йодистого изопропила, этилового спирта и диметилкарбинола? 4. Осуществите следующие превращения:
5. Напишите уравнение реакции окисления метилового спирта перманганатом калия в кислой среде до углекислого газа и воды.
Вариант 5.20
1. Составьте структурные формулы всех ароматических соединений, имеющих состав С7Н8О, и назовите их. 2. Назовите следующие соединения:
3. Получите этилизопропиловый эфир двумя методами. 4. Напишите уравнение реакции взаимодействия трет. бутилового спирта: а) с бромистоводородной кислотой, б) пятихлористым фосфором, в) металлическим натрием. 5. Какие вещества получаются при окислении диметилкарбинола бихроматом калия в кислой среде? Напишите уравнение реакции.
Вариант 6.21 1. Составьте структурные формулы всех изомеров, имеющих состав С3Н8О, и назовите их. К каким классам органических соединений они относятся? 2. Назовите следующие соединения:
3. Какие продукты получаются при внутри- и межмолекулярной дегидратации 3-метилбутанола-2? 4. На пропанол-2 последовательно подействовать треххлористым фосфором, спиртовым раствором щелочи, хлором и водным раствором щелочи. Написать уравнения реакций. 5. Напишите уравнение реакции окисления этилового спирта до уксусной кислоты бихроматом калия в кислой среде.
Вариант 7.22 1. Какие из ароматических соединений, имеющих состав С8Н10О, относятся к ароматическим спиртам, а какие – к фенолам? Дайте названия всем этим соединениям. 2. Назовите следующие соединения:
3. Из пропилена через ряд последовательных реакций получите диизопропиловый эфир. 4. Осуществите следующие превращения:
5. Напишите уравнение реакции окисления трет бутилового спирта бихроматом калия в кислой среде, если продуктами окисления являются ацетон, углекислый газ и вода.
Вариант 8.23 1. Составьте структурные формулы любого первичного, вторичного и третичного спирта и дайте им названия. 2. Назовите следующие соединения:
3. Какие продукты образуются при взаимодействии изопропилвторбутилового эфира с йодистоводородной кислотой? 4. С помощью каких реакций можно осуществить следующее превращение:
5. Напишите уравнение реакции окисления пропанола-1 до пропионовой кислоты бихроматом калия в кислой среде.
Вариант 9.24 1. Составьте структурные формулы только вторичных и третичных спиртов, имеющих состав С5Н12О, и назовите их. 2. Назовите следующие соединения:
3. Получите метилфениловый эфир двумя методами. 4. Из пропилового спирта рядом превращений получите 2,3-диметилбутан. 5. Напишите уравнение реакции окисления пропанола-2 бихроматом калия в кислой среде.
Вариант 10.25 1. Оставьте структурные формулы двухатомных фенолов, имеющих состав С7Н6(ОН)2, и назовите их. 2. Назовите следующие соединения:
3. Получите из пропилена: а) аллиловый спирт, б) пропандиол-1,2, в) диизопропиловый эфир. 4. Получите изобутиловый спирт и напишите уравнение реакции взаимодействия с трехбромистым фосфором, металлическим натрием и изопропиловым спиртом в присутствии концентрированной серной кислоты. 5. Отношение первичных, вторичных и третичных спиртов к действию окислителей. Напишите уравнение реакции окисления этилового спирта перманганатом калия в кислой среде.
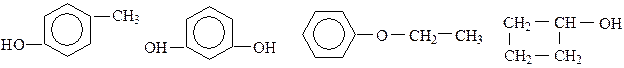
Вариант 11.26 1. Составьте структурные формулы всех фенолов, имеющих состав С8Н9ОН, и дайте им названия. 2. Назовите следующие соединения:
3. На бутиловый спирт подействуйте пятихлористым фосфором, а затем на полученное соединение – этилатом натрия. 4. Осуществите следующие превращения:
5. Напишите уравнение реакции окисления пропилового спирта перманганатом калия в кислой среде до пропионовой кислоты СН3СН2СООН.
Вариант 12.27 1. Составьте структурные формулы спиртов, имеющих состав С4Н9ОН, и дайте им названия. 2. Назовите следующие соединения:
3. Какие вещества образуются при нагревании этилизопропилового эфира с концентрированной йодистоводородной кислотой? 4. С помощью каких реакций можно превратить бензол в бензиловый спирт? Напишите уравнения соответствующих реакций. 5. Напишите уравнение реакции окисления изопропилового спирта до ацетона перманганатом калия в кислой среде.
Вариант 13.28 1. Составьте структурные формулы простых эфиров, имеющих состав С4Н10О, и дайте им названия. 2. Назовите следующие соединения:
3. Осуществите следующие превращения:
4. Каким образом можно разделить смесь фенола и циклогексилового спирта? 5. Отношение первичных, вторичных и третичных спиртов к действию окислителей. Напишите уравнение реакции окисления трет. бутилового спирта до ацетилена, углекислого газа и воды.
Вариант 14.29 1. Составьте структурные формулы непредельных спиртов, имеющих состав С4Н7ОH, и дайте им названия. 2. Назовите следующие соединения:
3. Напишите схему последовательного превращения н. бутилового спирта в дивтор. бутиловый эфир. 4. Осуществите следующие превращения:
5. Напишите уравнение реакции окисления пропилового спирта до пропионовой кислоты СН3СН2СООН перманганатом калия в кислой среде.
Вариант 15.30 1. Составьте структурные формулы простых эфиров, имеющих состав С4Н10О, и дайте им названия. 2. Назовите следующие соединения:
3. Какие продукты получаются при действии на втор. бутиловый спирт пятихлористым фосфором, а затем на полученное соединение – фенолятом натрия. 4. Осуществите следующие превращения:
Напишите уравнения реакций и назовите образовавшиеся на каждой стадии продукты. 5. Напишите уравнение реакции окисления изопропилового спирта перманганатом калия в кислой среде.
Способы получения a) окисление спиртов Окисление спиртов различными окислителями (KMnO4, K2Cr2O7 и др.) приводит к получению карбонильных соединений. Первичные спирты при окислении превращаются в альдегиды.
Вторичные спирты при окислении превращаются в кетоны.
b) каталитическое дегидрирование спиртов Из спиртов путем каталитического дегидрирования получают альдегиды и кетоны. Как и в предыдущем случае из первичных спиртов получают альдегиды, а из вторичных – кетоны.
c) щелочной гидролиз дигалогеналканов Щелочной гидролиз дигалогеналканов, содержащих атомы галогена у первичного атома углерода,приводит к получению альдегидов.
Если атомы галогенов принадлежат вторичному атому углерода, то в этом случае гидролиз дигалогеналканов приводит к получению кетонов.
d) каталитическая гидратация алкинов (реакция Кучерова) В результате гидратации ацетиленовых углеводородов в присутствии солей ртути образуются карбонильные соединения. Если каталитической гидратации подвергается ацетилен, то в результате образуется уксусный альдегид. В случае гидратации гомологов ацетилена образуются кетоны.
Физические свойства
Химические свойства Карбонильные соединения – реакционноспособные органические вещества, вступающие в реакции различного типа: присоединения, замещения, окисления, конденсации, полимеризации.
I. Реакции присоединения по карбонильной группе В общем виде реакции присоединения реагента НХ по карбонильной группе можно представить следующим образом:
Таким образом, реакция присоединения происходит по месту разрыва поляризованной кратной связи С=О. a) каталитическое гидрирование В результате каталитического гидрирования (восстановления) карбонильных соединений образуются спирты. Гидрирование альдегидов приводит к получению первичных спиртов:
Гидрирование кетонов приводит к получению вторичных спиртов:
b) взаимодействие с синильной кислотой (НСN) Реакция присоединения HCN к карбонильным соединениям протекает с образованием оксинитрилов (циангидринов). В эту реакцию вступают как альдегиды, так и кетоны.
c) взаимодействие с гидросульфитом натрия (NaНSO3)
В реакцию присоединения гидросульфита натрия вступают как альдегиды, так и кетоны. Эта реакция используется для очистки карбонильных соединений.
e) взаимодействие с магнийорганическими соединениями (реактивом Гриньяра) В результате протекания реакций взаимодействия карбонильных соединений с реактивом Гриньяра образуются алкоголяты, последующий гидролиз которых приводит к получению спиртов. Первичные спирты образуются при реакции формальдегида с магнийорганическими соединениями:
Вторичные спирты образуются при реакции альдегида с магнийорганическими соединениями:
Третичные спирты образуются при реакции кетона с магнийорганическими соединениями:
II. Реакеции замещения Карбонильные соединения вступают в реакции замещения. Замещение атома кислорода карбонильной группы происходит в случаях взаимодействия альдегидов и кетонов с пентахлоридом фосфора, аммиаком и его производными.
a) взаимодействие с пентахлоридом фосфора В реакцию взаимодействия с PCl5 вступают как альдегиды, так и кетоны:
b) взаимодействие с аммиаком В реакцию взаимодействия с аммиаком вступают только альдегиды с образованием иминов, способных к циклизации
c) взаимодействие с гидразином
В реакцию взаимодействия с гидразином вступают как альдегиды, так и кетоны. Продуктами данной реакции являются гидразоны.
d) взаимодействие с гидроксиламином Также как и в случае с гидразином в реакцию взаимодействия с гидроксиламином вступают как альдегиды, так и кетоны. Продуктами данной реакции являются оксимы.
Вопросы для самоконтроля Вариант 1.16 1. Составьте структурные формулы всех карбонильных соединений, имеющих состав С4Н8О, и дайте им названия. 2. Получите метилизопропилкетон по реакции Кучерова. Напишите уравнения реакции. 3. Какие галогенопроизводные следует взять для получения изомасляного альдегида? Дайте уравнения реакции. 4. Назовите следующие альдегиды. Какие из них способны к реакции альдольной конденсации?
Напишите уравнения реакций. 5. Осуществите следующие превращения:
Вариант 2.17 1. Составьте структурные формулы всех кетонов, имеющих состав С5Н10О, и дайте им названия. 2. Какой спирт нужно окислить подкисленным раствором бихромата калия, чтобы получить этилтретбутилкетон? Напишите уравнение реакции и расставьте коэффициенты. 3. Какие дигалогенопроизводные нужно взять для получения 2-метилпропаналя? Напишите уравнение реакции. 4. Напишите уравнение реакции Канниццаро для бензойного альдегида. 5. Осуществите следующие превращения:
Вариант 3.18 1. Составьте структурные формулы всех карбонильных соединений, имеющих состав С4Н6О, и дайте им названия. 2. Какое карбонильное соединение образуется при окислении диизопропилкарбинола бихроматом калия в кислой среде? Составьте уравнение реакции и расставьте коэффициенты. 3. Получите ацетальдегид по реакции Кучерова. Напишите уравнение реакции и укажите условия ее протекания. 4. Напишите уравнение альдольной конденсации и отщепления воды от образовавшегося продукта для пропионового альдегида. Назовите промежуточное и конечное соединения. 5. Напишите уравнения реакций взаимодействия ацетона со следующими веществами: а) пятихлористым фосфором, б) гидроксиламином, в) синильной кислотой и последующим гидролизом образовавшегося соединения.
Вариант 4.19 1. Составьте структурные формулы альдегидов, имеющих состав С5Н10О, и дайте им названия. 2. При пиролизе какой соли образуется масляный альдегид? Напишите уравнение реакции. 3. Какой кетон образуется при гидролизе 3,3-дихлор-2-метилбутана? Напишите уравнение реакции. 4. Что представляют собой продукты окисления метилэтилкетона? 5. Напишите уравнения реакций взаимодействия изомасляного альдегида со следующими веществами: а) синильной кислотой, б) бисульфитом натрия, в) гидразином.
Вариант 5.20 1. Составьте структурные формулы кетонов, имеющих состав С6Н12О, и дайте им названия. 2. Какой кетон образуется при гидратации метилацетилена (реакция Кучерова)? Напишите уравнение реакции и укажите условия проведения. 3. При окислении какого спирта образуется изомасляный альдегид? Напишите уравнение реакции окисления этого спирта бихроматом калия в кислой среде и расставьте коэффициенты. 4. Из бензальдегида получите диэтилацеталь. Напишите уравнение реакции. 5. Какие продукты образуются при взаимодействии триметилуксусного альдегида со следующими веществами: а) б) PCl5, в) NH2-NH2, г) HCN. Напишите уравнения реакций.
Вариант 6.21 1. Составьте структурные формулы всех жирноароматических кетонов, имеющих состав С9Н10О, дайте им названия. 2. При каталитической гидратации какого ацетиленового углеводорода по реакции Кучерова образуется метилизобутилкетон? Дайте уравнение реакции. 3. Какой альдегид образуется при гидролизе 1,1-дибром-2-метил-3-этилпентана? Дайте уравнение реакции. 4. С помощью каких реакций можно отличить пропионовый альдегид от изомерного ему кетона? 5. Осуществите следующие превращения:
Вариант 7.22 1. Составьте структурные формулы ароматических альдегидов, имеющих состав С8Н8О, и дайте им названия. 2. Какой ацетиленовый углеводород нужно взять для получения по реакции Кучерова метилизобутилкетона? Дайте уравнения реакции. 3. Напишите уравнение реакции окисления этилизопропилкарбинола бихроматом калия в кислой среде и расставьте коэффициенты. 4. Напишите уравнение реакции, с помощью которой можно выделить карбонильные соединения из смеси веществ, принадлежащих другим классам органических соединений. 5. Осуществите следующие превращения:
|
|||||||
|
Последнее изменение этой страницы: 2017-02-22; просмотров: 368; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.116.85.96 (0.01 с.) |


 Московский государственный машиностроитеьныйуниверситет
Московский государственный машиностроитеьныйуниверситет 103031, Москва, ул. Б. Дмитровка, д. 23/8, стр. 1-2
103031, Москва, ул. Б. Дмитровка, д. 23/8, стр. 1-2








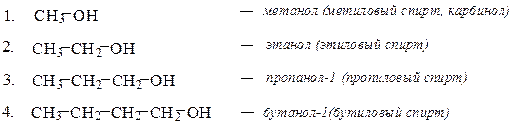
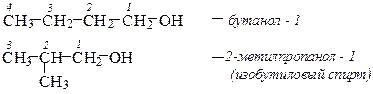





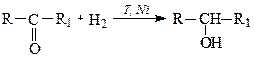




















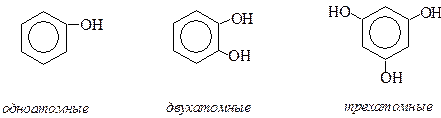






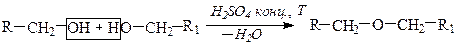
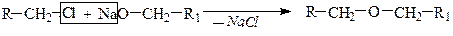

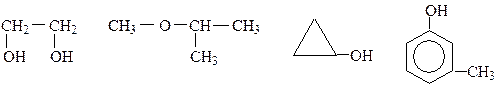
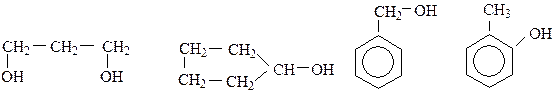
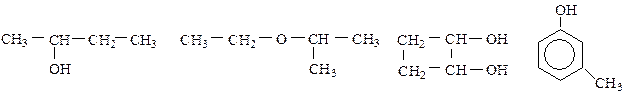


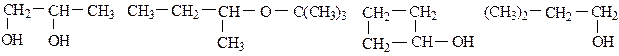

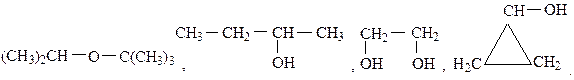
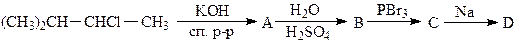
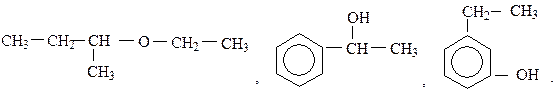


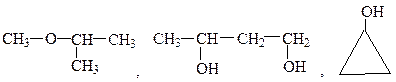

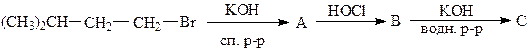




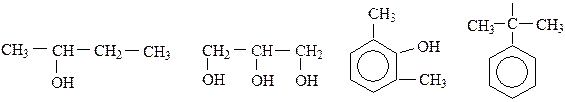


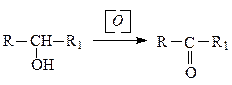


























 ,
,




