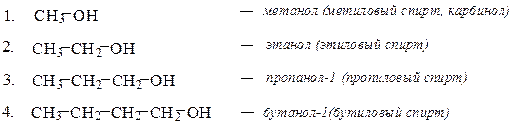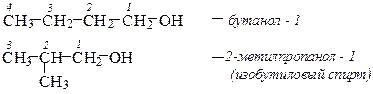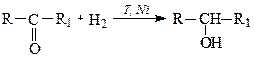Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Кислородсодержащие органические соединенияСодержание книги
Поиск на нашем сайте .
Методическое пособие
Москва МГМУ Учебное издание
Составители: Афонина Людмила Петровна Беспалов Гелий Николаевич Исаева Галина Сергеевна Стрельцова Елена Дмитриевна
Кислородсодержащие органические соединения Редактор В.И. Лузева
Формат бум. 60 x 84 1/16. Объем усл. п. л. 5,0. Уч.-изд. л. 4,0. Тираж 500 экз. Зак. МГМУ, издательский центр, 105066 Москва, Старая Басманная ул., 21/4 Отпечатано на предприятии ООО «Промгрупп»
В настоящем пособии рассматриваются следующие классы кислородсодержащих органических соединений: спирты, фенолы, альдегиды и кетоны, карбоновые кислоты и их производные.
Спирты Спиртами называются производные углеводородов, в которых один или несколько атомов водорода заменены на гидроксильные группы (оксигруппы) – ОН. Номенклатура В названии спиртов широкое распространение получила тривиальная номенклатура спиртов, в соответствии с которой название производится от углеводородного радикала в сочетании со словом «спирт». Использование такого принципа построения названия спиртов возможно в случаях несложных радикалов. По рациональной номенклатуре более сложные по строению спирты можно рассматривать как производные метилового спирта – карбинола. При построении названия спиртов в соответствии с номенклатурой ИЮПАК к названию углеводорода с самой длинной цепью, включающей гидроксильную группу, добавляется суффикс ол и цифра, обозначающая номер атома углерода, с которым связана гидроксильная группа. Нумерацию цепи начинают с того конца, ближе к которому расположена функциональная группа. При названии многотомных спиртов используют умножающие приставки ди-, три- и т.д.
Классификация спиртов: 1. по атомности, т.е. по числу гидроксильных групп в молекуле, различают: · одноатомные спирты (алкоголи R-OH)
· двухатомные спирты (гликоли, диолы R(OH)2)
· трехатомные спирты (триолы R(OH)3)
Двух-,трех- и т.д. спирты называтся многоатомнами.
2. по строению углеводородного радикала различают: · алифатические предельные и непредельные:
· циклические:
· ароматические:
3. по принадлежности функциональной группы к атому углерода различают:
Предельные одноатомные спирты Сn H2n+1OH ( n≥1 ) Гомологический ряд
Изомерия Изомерия спиртов обусловлена строением углеводородного радикала (изомерия углеродного скелета) и положением функциональной группы. изомерия цепи
изомерия положения функциональной группы
Предельные одноатомные спирты изомерны другому классу кислородсодержащих углеводородов– простым эфирам R-O-R1
Способы получения спиртов
1. Каталитическая гидратация алкенов Реакциягидратацииалкенов происходит в присутствии катализатора серной кислоты. Присоединение молекулы воды по месту разрыва кратной связи происходит в соответствии с правилом Марковникова.
2. Щелочной гидролиз галогеналканов
3. Гидрирование альдегидов и кетонов В реакции гидрирования альдегидов образуются первичные спирты.
Вторичные спирты образуются при гидрировании кетонов.
Гидрирование карбонильных соединений является реакцией восстановления.
4. Гидролиз сложных эфиров (кислотный и щелочной) Реакция гидролиза сложных эфиров, протекающая в кислой среде, является обратимой.
Необратимый гидролиз сложных эфиров происходит в щелочной среде.
Специфические способы получения СН3ОН и С2Н5ОН Синтез из водяного газа
Спиртовое брожение глюкозы
Физические свойства
Первые десять членов гомологического ряда предельных одноатомных спиртов являются жидкостями, высшие спирты – твердые вещества. По сравнению с соответствующими углеводородами, спирты обладают аномально высокими значениями Ткип по сравнению. Это объясняется ассоциацией молекул спиртов вследствие образования межмолекулярных водородных связей.
Все предельные одноатомные спирты легче воды, бесцветны. Метанол, этанол, пропанол неограниченно растворяются в воде; с увеличением числа атомов углерода растворимость спиртов уменьшается.
Химические свойства
Функциональная группа спиртов - гидроксил – обуславливает химические свойства этого класса кислородсодержащих углеводородов. Молекулы спиртов содержат полярные связи С – О и О – Н. На атоме водорода и углерода имеется дефицит электронной плотности, а на атоме кислорода – избыток электронной плотности. Такой электронный характер гидроксильной группы предполагает ее склонность к реакциям разрыва либо связи С – О, либо связи О – Н. Тем не менее, в водных растворах диссоциация О – Н связи не происходит. Спирты не являются электролитами. Водные растворы спиртов не изменяют цвет индикаторов.
Реакции замещения
1) Взаимодействие с активными металлами При реакции спиртов с металлами происходит замещение атома водорода в группе –ОН атомами металлов (образуются алкоголяты):
Алкоголяты подвергаются необратимому гидролизу, что в свою очередь доказывает - спирты не проявляют кислотные свойства (точнее являются более слабыми кислотами по сравнению с водой).
2) Реакция этерификации При взаимодействии спиртов с карбоновыми кислотами образуются сложные эфиры.
3) Замещение гидроксильной группы на атом гелогена Спирты обратимо реагируют с галогеноводородными кислотами (HHal) с образованием галогеналканов.
Спирты можно превратить в галогеналканы также действием галогенидов фосфора.
4) Замещение гидроксильной группы на аминогруппу Спирты взаимодействуют с аммиаком с образованием аминов. В случае протекания реакции в присутствии избытка спирта возможно образование наряду с первичными аминами вторичных и третичных аминов.
|
||
|
Последнее изменение этой страницы: 2017-02-22; просмотров: 289; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.214 (0.006 с.) |

 103031, Москва, ул. Б. Дмитровка, д. 23/8, стр. 1-2
103031, Москва, ул. Б. Дмитровка, д. 23/8, стр. 1-2