
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Роль каталізаторів в хімічній технологіїСодержание книги
Поиск на нашем сайте
Застосування каталізаторів для прискорення реакцій в сучасних технологічних процесах набуло широкого розповсюдження і, безумовно, буде все більше розширюватися. В багатьох складних реакціях каталізатор дозволяє направити процес в потрібному напрямку внаслідок вибірковості (селективності) дії. Слід пам’ятати, що каталізатори не здатні зміщувати хімічну рівновагу. Каталізатор звичайно не входить до складу кінцевого продукту реакції, хімічно незмінний (проте фізично каталізатор в процесі роботи може змінюватися і руйнуватися) і практично витрачається в незначних кількостях в порівнянні з кількостями основних реагентів. Технологічні умови здійснення каталітичних реакцій відмінні для гомогенного і гетерогенного каталізу. У гомогенному каталітичному процесі каталізатор знаходиться в тій же фазі, що й реагенти, тобто в рідкому або газоподібному вигляді. За гомогенного каталізу в більшості випадків утворюються проміжні нестійкі сполуки, що обумовлюють прискорення всього процесу завдяки зменшенню енергії активації і ланцюговим реакціям. Гетерогенний каталіз, тобто процес, в якому каталізатор і реагенти знаходяться в різних фазах, має в сучасній хімічній технології особливо широке розповсюдження. Явище гетерогенного каталізу складніше і різноманітніше від явищ гомогенного каталізу. Незважаючи на те, що в наш час існує кілька теорій гетерогенного каталізу, пошук найбільш ефективних каталізаторів до цього часу в переважній більшості випадків здійснюється емпіричним шляхом або за аналогією. Та все ж при доборі каталізаторів зростаючого значення набувають теоретичні передбачення і міркування. Сучасна наука, зокрема теорія квантових розрахунків, надає цьому напрямку великої ваги. Активність більшості каталізаторів з часом зменшується; деякі з них втрачають активність впродовж кількох годин і навіть хвилин, інші ж працюють місяці і роки. Для кожного технологічного процесу існують оптимальні інтервали температур, тисків, концентрацій реагентів і швидкості їх проходження через каталізатор. Оптимальна температура дії каталізатора називається температурою запалення каталізатора, нижче неї послаблюється дія каталізатора, вище – зменшується вихід продукту екзотермічної реакції. У відповідності до широко розповсюджених уявлень, проміжними утвореннями, через які протікає каталітичний процес на поверхні контакту, є молекули, адсорбовані під дією хімічних сил (активована адсорбція). У результаті такої взаємодії з поверхнею послаблюється міжатомні зв’язки і суттєво знижується енергія активації процесу. Тому величезне значення має не лише склад, а й спосіб приготування каталізаторів. Реагенти, які здатні каталізувати активні центри або механічно покрити поверхню каталізатора або ж утворити з ними неактивні хімічні сполуки, носять назву каталітичних отрут. Такі речовини прагнуть видалити з реакційної зони. Значну частину каталізаторів (особливо дорогих) регенерують шляхом хімічних, термічних та механічних операцій. Термохімічні розрахунки Хімічна взаємодія, як правило, супроводжується тепловим ефектом. При цьому теплота може і поглинатися, і виділятися. Процеси, що протікають з виділенням теплоти називаються екзотермічними, для яких характерне поглинання теплоти – ендотермічними. Рівняння процесу, що враховує тепловий ефект, називається термохімічним. Наприклад: N2(газ) + 3H2(газ) ⇄ 2NH3(газ) + 92,30 КДж Тепловий ефект реакції необхідно характеризувати не лише абсолютною величиною, але й знаком. Історично склалось дві системи відліку: термохімічна й термодинамічна. У першій із них тепловий ефект екзотермічної реакції рахується позитивним (екзо-зовнішній). Ендотермічні реакції супроводжуються негативним тепловим ефектом, теплота поглинається системою (ендо-внутрішній). У термодинаміці прийнята зворотна система знаків, тобто теплота, що поглинається системою рахується позитивною, а теплота, яку система виділила в оточуючий простір – негативною. В термодинамічній системі знаків тепловий ефект реакції ототожнюється із зміною ентальпії системи N2(газ) + 3H2(газ) ⇄ 2NH3(газ) Глибоке узагальнення термохімічних закономірностей дає закон термохімії, сформульований в 1836 р. російським академіком Германом Івановичем Гессом: тепловий ефект хімічної реакції, що протікає або при сталому об’ємі або при сталому тиску, не залежить від числа проміжних стадій, а визначається лише початковим і кінцевим станом системи. Закон Гесса можна проілюструвати схемою
 A + B = AB A + B = AB
  ∆H ∆H
Із закону Гесса витікає кілька наслідків: 1. Тепловий ефект реакції утворення одного моля сполуки із простих речовин в стандартному стані при заданих Т, Р не залежать від способу утворення сполуки. Такий тепловий ефект називається теплотою утворення. У термодинаміці в якості стандартних умов приймається температура 250С=298К і тиск 1,0132•ּ105 Па. 2. Другий наслідок закону Гесса дозволяє розрахувати тепловий ефект реакції за теплотами утворення вихідних речовин і продуктів взаємодії. Він формулюється: стандартний тепловий ефект реакції рівний алгебраїчній різниці суми стандартних теплот утворення продуктів реакції і суми стандартних теплот утворення вихідних речовин (із врахуванням стехіометричних коефіцієнтів): аА + вВ = сС + dD
РОЗДІЛ 4. ТЕПЛОВІ ПРОЦЕСИ Основи теплопередачі Перенос енергії у формі тепла, що відбувається між тілами з різною температурою, називається теплообміном. Рушійною силою будь-якого процесу теплообміну є різниця температур більш нагрітого і менш нагрітого тіл, за наявності якої тепло самочинно, у відповідності до другого закону термодинаміки, переходить від більш нагрітого до менш нагрітого тіла. Теплообмін між тілами є обміном енергією між молекулами, атомами і вільними електронами; в результаті теплообміну інтенсивність руху частинок більш нагрітого тіла знижується, а менш нагрітого – зростає. Розрізняють три принципово відмінних елементарних способи розповсюдження тепла: теплопровідність, конвекцію та теплове випромінення. Теплопровідність – це перенос теплоти внаслідок безладного (теплового) руху мікрочастинок, що дотикаються одна до одної. Цей рух може бути або рухом самих молекул (гази, краплинні рідини), або коливаннями атомів (у кристалічній гратці твердих тіл), або дифузією вільних електронів (у металах). У твердих тілах теплопровідність є зазвичай основним видом розповсюдження теплоти. Конвекцією називається перенос теплоти внаслідок руху і переміщення макроскопічних об’ємів газів або рідин. Перенос теплоти можливий за умов природної, або вільної, конвекції, що обумовлена різницею густини у різних точках об’єму рідини (газу), що виникає унаслідок різниці температур у цих точках або за умов вимушеної конвекції при примусовому русі усього об’єму рідини, наприклад у разі переміщування її мішалкою. Теплове випромінення – це процес розповсюдження електромагнітних коливань з різною довжиною хвилі, обумовлений тепловим рухом атомів і молекул тіла, що випромінює теплоту. Всі тіла здатні випромінювати енергію, яка поглинається іншими тілами і знову перетворюватися у теплоту. Таким чином, відбувається променевий теплообмін, він складається із процесів випромінення і поглинання променів. За реальних умов теплота передається не яким-небудь одним із зазначених вище способів, а комбінованим шляхом. Перенос теплоти від стінки до газуватого (рідкого) середовища або у зворотному напрямку називається тепловіддачею. Ще більш складним є процес передачі теплоти від більш нагрітої до менш нагрітої рідини (газу)через поверхню або стінку, що їх розділяє. Цей процес називається теплопередачею.
|
||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-02-22; просмотров: 250; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.188.218.140 (0.006 с.) |

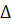 Н. При запису термодинамічного рівняння в цій системі тепловий ефект не включається в рівняння процесу, а записується в одній строчці з рівнянням, але з інтервалом. Так, наведене вище рівняння, матиме вигляд:
Н. При запису термодинамічного рівняння в цій системі тепловий ефект не включається в рівняння процесу, а записується в одній строчці з рівнянням, але з інтервалом. Так, наведене вище рівняння, матиме вигляд:
 = [c
= [c  (D)] – [a
(D)] – [a 


