
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Розділ 11. Електрохімічні виробництва
Понад 40% всієї енергії, що використовується в хімічній промисловості – електрична. Хімічна промисловість випускає 6% всієї промислової продукції, а споживає 12% електроенергії. Це одна із найбільш енергоємних галузей промисловості. Окрім допоміжних операцій (транспортування, робота апаратів) електроенергію використовують у процесах двох видів: - електротермічних; - електрохімічних; Електрохімічні виробництва, у свою чергу, поділяються на два види: гальваніка і електроліз. Спільним у них є те, що обидва процеси – окисно-відновні, тобто має місце обмін електронами, а отже і зміна величини ступеня окиснення елементів. Гальванічний процес – це такий самочинний окисно-відновний процес, в ході якого за допомогою спеціальних пристосувань вдається перетворити хімічну енергію в електричну. Схему такого пристрою наведено на рис. 11.1.
Zn – 2e → Zn2+
Cu2++ Zn0 + 2e→ Zn2+ + Cu0 Ідентичний процес має місце в пробірочній реакції: CuSO4 + Zn = ZnSO4 + Cu Проблемне питання: Чому в першому випадку прилад фіксує електричний струм, а в другому його нема? Відповідь: Конструкція приладу гальванічного елемента Даніеля-Якобі така, що катодний і анодний простори відокремлені, виникає направлене переміщення електронів.
Як розподіляються в такому разі функції речовин, що утворюють гальванічну пару? Відповідь на це питання дивитися в табл. 11.1. Таблиця 11.1 Функції речовин у гальванічному елементі
Електроліз – це такий окисно-відновний процес, який можливий лише у разі накладання на електроди достатнього потенціалу від зовнішнього джерела постійного електричного струму.
Для протікання електролізу необхідне обладнання: - електролізер; - мінімуму два електроди; - джерело постійного струму. При електролізі в системі почергово відбуваються первинні і вторинні процеси: Первинні процеси включають в себе:
II стадія: Міграція йонів до поверхні електродів: K(-) A(+) Na+ Cl- III стадія: Власне окисно-відновний процес: Na+ + ē → Na0 Cl- - ē = Cl0 Між електродами, вихідними речовинами і продуктами електролізу можлива взаємодія, тобто вторинні, як правило хімічні процеси, у нашому разі – це має місце в анодному просторі: 2Cl0→Cl2. Порядок відновлення та окиснення залежить від багатьох факторів: Основні: – природа електроліту; - конструкція електролізеру; - природа електродного матеріалу; Другорядні: - концентрація електроліту; - температура електроліту; - форма електроду; - інтенсивність перемішування тощо;
|
||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-02-22; просмотров: 213; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.225.234.234 (0.004 с.) |
 Хімізм процесу:
Хімізм процесу: Cu2+ + 2e → Cu0
Cu2+ + 2e → Cu0 На сьогодні не існує способу визначити абсолютну величину потенціалу, тому його визначають за відношенням до умовного нуля – водневого електроду(рис. 11.2) У такому пристрої роль електроду – виконує платина, покрита платиновою черню, що адсорбує на себе дигідроген, в електролізері знаходиться HCl, a(H+)= 1моль/л. Створюючи пари водневий електрод – металічний електрод, були визначені стандартні електродні потенціали металів, що були розміщені в послідовний ряд, так утворився ряд активності металів. Гальванічні процеси – самочинні, виникають в разі контакту двох різнорідних речовин за умов наявності струмопровідного середовища.
На сьогодні не існує способу визначити абсолютну величину потенціалу, тому його визначають за відношенням до умовного нуля – водневого електроду(рис. 11.2) У такому пристрої роль електроду – виконує платина, покрита платиновою черню, що адсорбує на себе дигідроген, в електролізері знаходиться HCl, a(H+)= 1моль/л. Створюючи пари водневий електрод – металічний електрод, були визначені стандартні електродні потенціали металів, що були розміщені в послідовний ряд, так утворився ряд активності металів. Гальванічні процеси – самочинні, виникають в разі контакту двох різнорідних речовин за умов наявності струмопровідного середовища.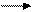 І стадія: Дисоціацію електроліту на йони (вона може відбуватись під дією високої температури у розплаві або під дією полярних молекул води в розчині): NaClкр. t° Na + Cl-
І стадія: Дисоціацію електроліту на йони (вона може відбуватись під дією високої температури у розплаві або під дією полярних молекул води в розчині): NaClкр. t° Na + Cl-


