
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Проблема “зв’язаного” нітрогену
Нітрогеновмісні сполуки використовуються для виробництва: - нітратної кислоти; - мінеральних добрив; - вибухових речовин; - формацевтичних засобів; - полімерів (пластмаси і синтетичні волокна); - барвників. Основне джерело нітрогену – атмосфера (4 · 1015 тонн). N≡N – міцна молекула, енергія зв’язку становить 940,5 кДж/моль. У молекулі має місце sp-гібридизація атомних орбіталей нітрогенів, в наслідок чого атоми в молекулі N2 з’єднані потрійним зв’язком (1 δ-зв’язок і 2 π-зв’язки). На початку ХХ століття майже одночасно були розроблені три технічних методи синтезу сполук із молекулярного нітрогену: 1. Дуговий метод:
Цей метод іноді називають методом низькотемпературної плазми (2200°С) Далі здійснюється доокиснення NO → Ca(NO3)2 2NO + Ca(OH)2 + 1,5 O2 → Ca(NO3)2 + H2O Eзатрати = 7·104 кДж/тонну. 2. Ціанамідний метод: CaC2 + N2 → Ca=N–C≡N + C ∆H = +300 кДж тонкоподрібнений кальцій ціанаміду карбід кальцію Наступна стадія: гідратація кальцій ціанаміду: Ca=N–C≡N + 3HOH → CaCO3 + 2NH3 Eзатрати = 1,2 · 104 кДж/тонну. 3. Амоніачний метод: N2 + 3H2 ↔ 2NH3 ∆H = − 111,6 кДж Eзатрати = 0,5 · 104 кДж/тонну.
Одержання амоніаку Амоніак – безбарвний газ з різким запахом, з Ткип. = − 33,35°С, Тплавл. = −77,75°С. Добре розчиняється у воді (750 л в 1 л Н2О). Сировиною для виробництва амоніаку є азотоводнева суміш (АВС) стехіометричного складу N2: Н2 = 1: 3. Динітроген одержується шляхом ректифікації зрідженого повітря. Процес включає в себе 3 стадії: І стадія. Очистка повітря: Від пилу – відбувається в масляних фільтрах, що являють собою резервуар з насадкою у формі кілець, що змащені мінеральним маслом; Від СО2 – очистка відбувається шляхом барботажу газу через водний розчин NаОН; Від водяної пари – очистка здійснюється шляхом адсорбції на силікагелі, алюмогелі, цеоліті або ж в результаті виморожування води. Адсорбційно вилучається і ацетилен С2Н2. ІІ стадія. Глибоке охолодження повітря з метою зрідження: І спосіб – ізоентальпічне розширення газу або адіабатичне розширення газу. Процес здійснюється у дросельних пристроях. ІІ спосіб – ізоентропічне розширення газу (з виконанням зовнішньої роботи). Процес здійснюється шляхом поєднання дросельного пристрою і поршневої або турбінної машини – в турбодетандері.
ІІІ стадія. Ректифікація рідкого повітря: Використовуються апарати одноразової і двохразової ректифікації. В першому випадку одержують азот, що містить не < 7% кисню. Дворазова ректифікація забезпечує 99,98% азоту. Ректифікаційне розділення повітря базується на різних температурах кипіння компонентів повітряної суміші (табл. 8.1).
Таблиця 8.1. Cклад повітря та температури кипіння його компонентів
В процесі ректифікації відбувається багаторазова конденсація і випаровування компонентів суміші (рис. 8.1).
Рис. 8.1. Апарат двохразової ректифікації повітря: 1, 2, 3 – дроселі; 4 – верхня колона; 5 – випарювач-конденсатор;6 – карман; 7 – нижня колона; 8 – куб. При роботі апарату стиснене до 12-20 мПа повітря, охолоджене до – 125°С, поступає в змієвик нижньої частини колони, де охолоджується до – 160°С повітряно-кисневою сумішшю. Далі повітря дроселюється і поступає на середні палички нижньої колони. Пара збагачена легкокиплячим динітрогеном, піднімається догори і конденсується у випарювачі-конденсаторі (3), а рідина збагачена диоксигеном стікає вниз. У карманах збирається рідина, збагачена динітрогеном (99,5%). З карманів динітроген (флегма) подається на орошення верхньої колони. Повітряно-киснева суміш (40 % О2 за об’ємом) із нижньої колони подається в середню частину верхньої колони. Угорі верхньої частині збираються пари динітрогену (N2 % - 99,998), внизу – рідкий диоксиген (О2 % - 92-95). Дигідроген у промисловості може бути одержаний наступними методами: 1) розділенням коксового газу; 2) газифікацією твердого палива; 3) електролізом водних розчинів натрієвих та калійних солей; 4) термічним розкладом природного газу; 5) конверсією природного газу (90% від загальної кількості). Конверсія природного газу здійснюється: а) водяним паром (Н2О): СН4 + Н2О ↔ СО + 3Н2 ∆Н = 206 кДж Рівноважний ступінь перетворення зростає при підвищенні температури та збільшенні співвідношення реакційної суміші (Н2О: СН4). Тиск лише збільшує швидкість, вихід за умови високого тиску падає.
б) диоксигеном (О2): СН4 + 0,5О2 ↔ СО + 2Н2 ∆Н = − 35 кДж. в) вуглекислим газом (карбон (IV) оксидом): СН4 + СО2 ↔ 2СО + 2Н2 ∆Н = + 248 кДж. На наступному етапі відбувається конверсія карбон (ІІ) оксиду водяною парою: СО + Н2О ↔ СО2 + Н2 ∆Н = − 41 кДж.
СО + Н2О ↔ СО2 + Н2 + 41 кДж СН4 + 2Н2О ↔ СО2 + 4Н2 − 165 кДж Конверсія СО прискорюється введенням каталізаторів (табл. 8.2.) Таблиця 8.2. Каталізатори процесу конверсії метану
|
||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-02-22; просмотров: 203; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.142.171.180 (0.009 с.) |
 N2 + O2 2 NO ∆H = 179,2 кДж
N2 + O2 2 NO ∆H = 179,2 кДж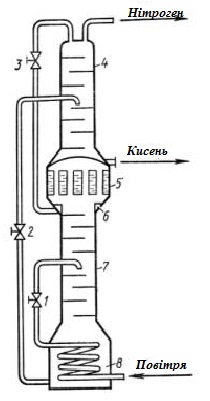
 Сумарно цей процес можна представити:
Сумарно цей процес можна представити: СН4 + Н2О ↔ СО + 3Н2 − 206 кДж
СН4 + Н2О ↔ СО + 3Н2 − 206 кДж


