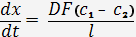Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Залежність швидкості процесу від температури
Вплив температури на швидкість реакції досить значний. Температура є найбільш сильним фактором прискорення реакції. Як правило залежність константи швидкості реакції від температури визначається рівнянням Арреніуса:
де k – константа швидкості реакції; А – енергія активації. В літературі часто наводиться емпіричне правило Вант-Гоффа, відповідно до якого при підвищенні температури на кожні 100 швидкість реакції зростає в 2-4 рази (в інтервалі температур від 10 до 100-3000С):
де υ – швидкість реакції; k – константа швидкості реакції; τ – час перебігу реакції; γ – температурний коефіцієнт, що знаходиться в межах від 2 до 4; Т – температура. Залежність швидкості від поверхні дотику На швидкість гетерогенних процесів суттєво впливає величина поверхні дотику реагентів і дифузія. Швидкість гетерогенного процесу пропорційна питомій поверхні фаз, що дотикаються: υ = k∙F де υ – швидкість; F – величина питомої поверхні; k – коефіцієнт пропорційності. Питома поверхня – відношення абсолютної поверхні до одиниці маси або об’єму тої фази, що містить реагент. Технологія користується різними засобами збільшення питомої поверхні дотику реагентів: а) подрібнення твердих тіл; б) розпилення рідин; в) барботажем (пробулькуванням) газу через рідину і таке інше. В хімічній технології здійснюють брикетування і агломерацію (спікання) сировини. Незважаючи на зменшення питомої поверхні в процесі брикетування і агломерації, більш рівномірне змішування реагентів при плавленні суміші, позитивно впливає на протікання процесу в цілому. Швидкість складного процесу визначається найбільш повільною його стадією, такою стадією часто є процес дифузії. Швидкість дифузії прямо пропорційна поверхні дотику реагентів і різниці концентрацій реагуючого компонента на межі шару, через який він дифундує, і обернено пропорційна товщині поверхневого шару. В загальному вигляді цей закон (відомий в літературі під назвою закону Фіка) виражається наступним рівнянням:
де D – коефіцієнт дифузії; F – поверхня дотику реагентів; с1 – концентрація реагенту в поверхневому шарі (концентрація насичення); с2 – концентрація реагенту в усьому об’ємі фази, що реагує; l – товщина дифузійного шару. Очевидно, що рушійну силу дифузії визначає градієнт концентрації. Коефіцієнт дифузії D виражає кількість речовини, яка дифундує через 1 см2 за одиницю часу при різниці концентрацій рівній одиниці.
|
||||
|
Последнее изменение этой страницы: 2017-02-22; просмотров: 234; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.141.100.120 (0.004 с.) |