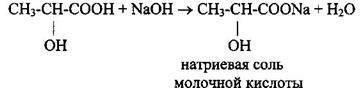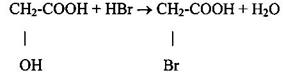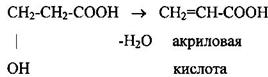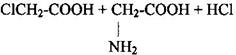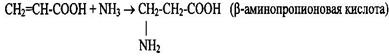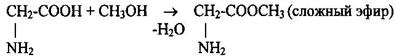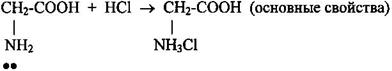Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Способы получения галогензамещённых кислотСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
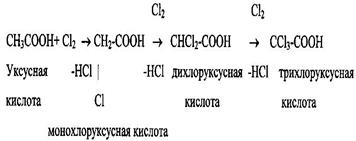
1 Замещение водорода в кислотах жирного ряда на галоген.
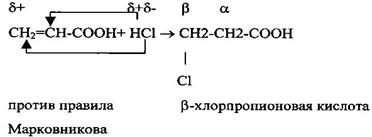
2 Присоединение галогенов или галогеноводорода к непредельным кислотам.
Химические свойства
Атомы галогена и карбоксильная группа в галогензамещённых кислотах обладают в основном обычными, характерными для этих функций свойствами. Так, галоген способен к реакциям замещения, карбоксильная группа проявляет кислотные свойства.
В этих реакциях участвовал галоген.
3 Образование солей и сложных эфиров с участием карбоксильной группы.
Гидроксикислоты
Гидроксикислоты – производные углеводородов, в молекуле которых присутствуют две функциональные группы - гидроксильная и карбоксильная. Способы получения гидроксикислот
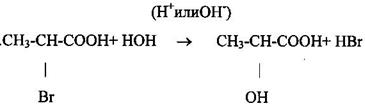
1 Гидролиз галогензамещённых кислот:
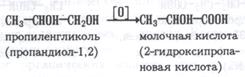
2 Окисление гликолей
3 Получение из альдегидов и кетонов через циангидрины
Химические свойства
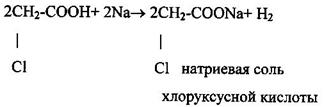
1 Образование солей и сложных эфиров (кислотные свойства)
2 Реакции с участием гидроксигруппы (спиртовые свойства)
бромуксусная кислота
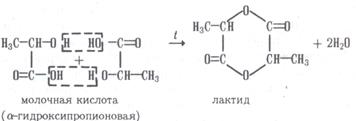
β - гидроксипропионовая кислота 3 Дегидратация гидроксикислот При дегидратации α-гидроксикислот образуется циклический продукт – лактид:
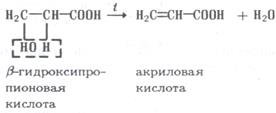
Дегидратация β-гидроксикислот приводит к образованию непредельных кислот:
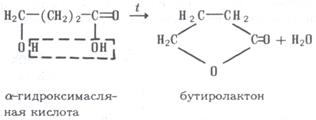
При дегидратации γ- и δ-гидроксикислот возникают сложные эфиры – лактоны:
Аминокислоты
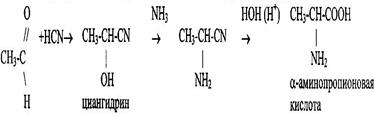
Аминокислоты – соединения, содержащие аминогруппу (-NН2) и карбоксильную группу (-СООН). Наибольшее значение имеют α-аминокислоты.
Способы получения
1 Замена галогена в галогензамещённых кислотах на аминогруппу при действии избытка аммиака.
2 Из альдегидов и кетонов действием синильной кислоты и аммиака.
3 Присоединение аммиака к непредельным кислотам
Химические свойства
Аминокислоты проявляют в реакциях амфотерные свойства - аминогруппа со свойствами основания, карбоксильная группа с кислотными свойствами. 1 Образование солей и сложных эфиров (кислотные свойства)
2 Реакции по аминогруппе:
Углеводы
Углеводы - это природные органические соединения, состав которых выражается общей формулой Сn(Н2О)m, (n, m›3). Класс углеводов объединяет: Моносахариды – С6Н12О6 - глюкоза, фруктоза Дисахариды - С12Н22О11 - сахароза Полисахариды - (С6Н10О5)n - крахмал, целлюлоза. Строение моносахаридов мы рассмотрим на примере глюкозы. Глюкоза - альдегидоспирт (доказано экспериментально).
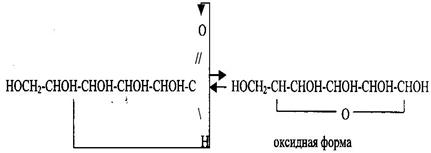
D (+) - глюкоза (альдегидная форма) У D - глюкозы гидроксигруппа у самого нижнего асимметричного атома стоит справа, у L - глюкозы - она стоит слева. Кроме альдегидной формы глюкоза может иметь циклическую (оксидную) форму. Это таутомерная модификация, находящаяся в равновесии с альдегидной формой:
Таутомерия
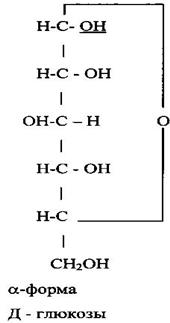
Оксидная форма может иметь два циклических изомера, называемых α- и β- формами:
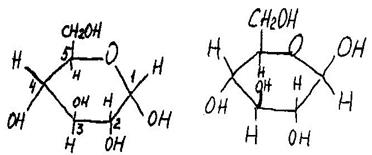
Гидроксигруппа у С-1, возникшая при переходе в циклическую форму, отличается от остальных гидроксигрупп. При действии метилового спирта и хлороводорода образуется два производных циклической формы. Такие соединения называют гликозидами, а в случае глюкозы - глюкозидами (глюкос - сладкий). Циклические, формулы, записанные выше, недостаточно наглядно передают пространственное строение молекулы. Поэтому используется более удобное написание этих формул:
α – D – глюкоза β – D – глюкоза Химические свойства
1 Восстановление
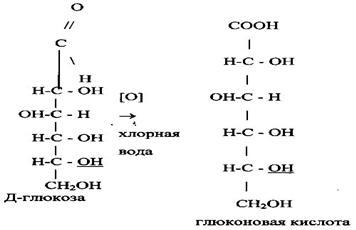
2 Окисление
Для глюкозы характерны реакции присоединения синильной кислоты, реакции замещения с гидразином, фенилгидразином.
3 Алкилирование приводит к образованию простых эфиров, которые являются производными циклических форм. Легче всего реагирует гликозидный гидроксил:
α- D – глюкоза глюкозид
4 Спиртовое брожение: С6Н12О6 → 2СО2 + 2С2Н5ОН (этиловый спирт)
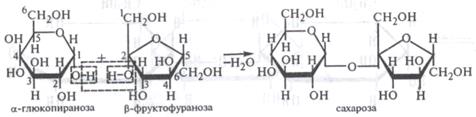
Дисахариды
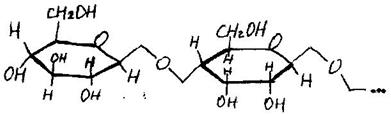
В молекулы дисахаридов входят циклические формы моносахаридов. Известны два типа дисахаридов, различие между которыми зависит от того, участвуют ли в создании связи через кислород оба гликозидных гидроксила (стоят у С-1) - невосстанавливающиеся дисахариды (сахароза) – а или один гликозидный и один спйртовой (4) – восстанавливающие дисахариды (целлобиоза, мальтоза, лактоза) – б. а)
б)
α-D – глюкоза мальтоза Химические свойства невосстанавливающих дисахаридов определяют гидроксильные группы, а восстанавливающих - альдегидная или кетонная группа и гидроксилы. Поэтому восстанавливающие дисахариды вступают в реакции, характерные для моносахаридов. Дисахариды легко гидролизуются при нагревании вводными растворами минеральных кислот или при действии ферментов, что приводит к образованию моносахаридов. Полисахариды
Молекулы полисахаридов можно рассматривать как продукты конденсации большого числа молекул моносахаридов друг с другом. Состав (СбН10О5)n. Являются продуктами фотосинтеза. Крахмал - полисахарид, построенный из нескольких тысяч остатков α - глюкозы.
Целлюлоза (клетчатка) - имеет линейное строение, но состоит из остатков β-глюкозы.
Невосстанавливающие углеводы. При гидролизе крахмал и целлюлоза образуют глюкозу (конечный продукт). При этом гидролиз целлюлозы протекает при более жестких условиях
(С6Н10О5)n + Н2О → nС6Н12О6(глюкоза)
[С6Н7О2(ОН)3]n + 3nНNО3 → [С6Н7О2(ОNО2)3]n + 3nН2О тринитрат целлюлозы
[С6Н7О2(ОН)3]n + 3nСН3СООН→[С6Н7О2(ОСОСН3)3]n + 3nН2О триацетат целлюлозы Ацетаты целлюлозы используют в производстве ацетатного волокна, а также для получения пластмасс, негорючей фото- и кинопленки, специальных лаков.
|
||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-02-19; просмотров: 1394; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.191.26.149 (0.011 с.) |