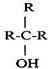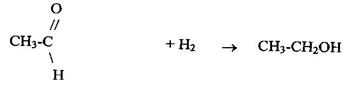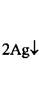Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Раздел 1 Строение органических веществСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Органическая химия
Методические указания и контрольные работы для студентов заочной формы обучения
для специальности: 18.02.09 «Переработка нефти и газа» (базовая подготовка)
2016г.
Разработала: Бекетова Т.В. – преподаватель высшей категории Сибирского казачьего института технологий и управления филиал ФГБОУ ВО «МГУТУ имени К.Г. Разумовского (Первый казачий университет)»
Рецензент: В.Г. Чудновская – преподаватель высшей категории Сибирского казачьего института технологий и управления филиал ФГБОУ ВО «МГУТУ имени К.Г. Разумовского (Первый казачий университет)»
Настоящие методические указания содержат программу учебной дисциплины «Органическая химия», методические указания к изучению разделов и тем дисциплины с вопросами для самоконтроля после каждого раздела, даны задания для выполнения контрольной работы для 10 вариантов по 8 заданий в каждом варианте и список рекомендуемой литературы. Методические указания предназначены для студентов заочной формы обучения, обучающихся в Сибирском казачьем институте технологий и управления (филиал) ФГБОУ ВО «МГУТУ имени К.Г. Разумовского (Первый казачий университет)» Университетском химико-механическом колледже по специальности 18.02.09 «Переработка нефти и газа». Содержание
Введение Целью методических указаний является реализация государственных требований к минимуму содержания и уровню подготовки выпускников специальности 18.02.09 «Переработка нефти и газа» (базовая подготовка) заочной формы обучения дисциплина «Органическая химия». Данная дисциплина изучается студентами-заочниками на 3 курсе. Изучение учебной дисциплины «Органическая химия» строится на основе классической теории химического строения А.М. Бутлерова, дополненной теоретическими основами современных представлений о строении атомов и молекул. Для закрепления теоретических знаний и приобретения основных умений предусмотрено проведение лабораторных и практических работ, выполнение одной контрольной работы и изучение дисциплины заканчивается экзаменом. Что позволит студентам получить систематизированные знания и умения, необходимые им в производственной деятельности техника-технолога. После изучения органической химии в соответствии с ФГОС СПО студент должен уметь: - составлять и изображать структурные полные и сокращенные формулы органических веществ и соединений; - определять свойства органических соединений для выбора методов синтеза углеводородов при разработке технологических процессов; - описывать механизм химических реакций получения органических соединений; - составлять качественные химические реакции, характерные для определения различных углеводородных соединений; - прогнозировать свойства органических соединений в зависимости от строения молекул; - решать задачи и упражнения по генетической связи между различными классами органических соединений; - определять качественными реакциями органические вещества, проводить количественные расчеты состава веществ; - применять безопасные приемы при работе с органическими реактивами и химическими приборами; - проводить реакции с органическими веществами в лабораторных условиях; - проводить химический анализ органических веществ и оценивать его результаты. знать: - влияние строения молекул на химические свойства органических веществ; - влияние функциональных групп на свойства органических веществ; - изомерию как источник многообразия органических соединений; - методы получения высокомолекулярных соединений; - особенности строения органических веществ, их молекулярное строение, валентное состояние атома углерода; - особенности строения и свойства органических веществ, содержащих в составе молекул атомы серы, азота, галогенов, металлов; - особенности строения и свойства органических соединений с большой молекулярной массой; - природные источники, способы получения и области применения органических соединений; - теоретические основы строения органических веществ, номенклатуру и классификацию органических соединений; - типы связей в молекулах органических веществ. Программа учебной дисциплины «Органическая химия»
Лабораторное занятие №1 Исследование качественного состава органических веществ. Практическое занятие № 1 Решение задач по установлению формул органических веществ.
Тема 1.2 Общие вопросы теории химического строения органических веществ Теория химического строения А.М.Бутлерова, её основные положения, значение и направления её развития. Структурные формулы органических веществ. Изомерия. Электронная конфигурация углеродного атома. Валентные состояния углеродного атома. Ковалентная связь, её основные характеристики. Гомо- и гетеролитический разрыв ковалентной связи. Классификация органических соединений. Классификация органических реакций. Раздел 2 Углеводороды Тема 2.1 Алканы
Гомологический ряд алканов, общая формула. Строение, sр3–гибридизация, σ - связь, её характеристика. Изомерия алканов. Конформации алканов. Первичные, вторичные, третичные, четвертичные атомы углерода. Алкильные радикалы. Номенклатура алканов: рациональная и современная (ЮПАК). Природные источники алканов. Способы их получения Физические и химические свойства алканов. Практическое значение реакций. Алканы – природное химическое сырье.
Лабораторное занятие №2 Получение метана, изучение его свойств и свойств, жидких алканов при обычных условиях. Практическое занятие №2 Составление структурных формул изомеров алканов, закрепление знаний номенклатуры, способов получения и свойств алканов
Тема 2.2 Циклоалканы
Строение, общая формула, гомологический ряд, изомерия, номенклатура. Нахождение в природе, способы получения. Физические и химические свойства. Зависимость свойств от строения циклов. Пространственное строение циклов. Применение.
Тема 2.3 Алкены
Общая формула, гомологический ряд, строение, sp2 − гибридизация. Двойная связь. Характеристика. Изомерия. Номенклатура. Способы получения алкенов: промышленные и лабораторные. Физические и химические свойства алкенов. Реакции электрофильного присоединения. Правило В.В. Марковникова. Окисление алкенов. Реакции алкилирования, полимеризации, качественные реакции на двойную связь Отдельные представители. Этилен. Пропилен. Получение, применение.
Лабораторное занятие№3 Получение этилена и исследование его свойств Практическое занятие№3 Составление формул изомеров алкенов, закрепление номенклатуры алкенов, схемы электрофильного присоединения, взаимного перехода алканов и алкенов.
Тема 2.4 Алкины
Общая формула, гомологический ряд. Строение. sp − гибридизация. Изомерия, номенклатура. Способы получения, физические и химические свойства. Реакции присоединения, полимеризации, замещения водорода. Качественные реакции. Ацетилен, его применение. Лабораторное занятие№4 Получение ацетилена, изучение его свойств Практическое занятие№4 Составление структурных формул изомеров алкинов, закрепление знаний номенклатуры и взаимного перехода алканов, алкенов, алкинов Лабораторное занятие№5 Исследование химических свойств бензола, толуола, нафталина и их способность к реакциям окисления Практическое занятие№5 Закрепление знаний способов получения и свойств бензола и его гомологов, правил ориентации в ароматическом ядре; взаимных превращений углеводородов. Обобщение знаний по разделу «Углеводороды»
Контрольная работа №1 по разделу «Углеводороды» 1. Задание по номенклатуре. 2. Цепь взаимопревращений или сравнение свойств углеводов. 3. Расчетная задача или задание на знание реакции Вюрца. Лабораторное занятие№6 Получение галогенопроизводных углеводородов Лабораторное занятие№7 Исследование физических и химических свойств одноатомных и многоатомных спиртов Лабораторное занятие№8 Исследование влияние бензольного кольца и гидроксигруппы на химические свойства фенола. Качественное подтверждение наличие фенола в растворе. Практическое занятие№6 Составление структурных формул спиртов. Закрепление знаний их номенклатуры, способов получения, свойств гидроксидных соединений. Установление структурных формул исходных веществ по продуктам реакции. Тема 3.3 Альдегиды и кетоны Альдегиды и кетоны. Общая формула. Гомологические ряды. Изомерия. Номенклатура. Способы получения. Характеристика физических свойств альдегидов и кетонов. Химические свойства карбонильной группы Влияние радикала. Реакции присоединения, замещения карбонильного кислорода, альфа-водорода. Реакции полимеризации альдегидов. Реакции конденсации: альдольная и кротоновая. Окисление альдегидов и кетонов. Сходства и различия в свойствах альдегидов и кетонов. Качественные реакции. Наиболее важные представители: формальдегид, ацетальдегид, ацетон. Получение ацетальдегида и ацетона на ОАО «Омский каучук». Ненасыщенные карбонильные соединения: акролеин, свойства, получение, взаимное влияние карбонила и двойной связи.
Лабораторное занятие№9 Исследование свойств альдегидов и кетонов, их качественные реакции Практическое занятие№7 Составление структурных формул изомеров, закрепление знаний их номенклатуры. Составление схем синтезов альдегидов и кетонов из заданных реактивов. Решение расчётных задач. Лабораторные занятия№10 Изучение свойств одноосновных предельных и непредельных, двухосновных кислот. Мыло Лабораторное занятие№11 Получение и исследование свойств производных карбоновых кислот Практическое занятие№8 Составление структурных формул карбоновых кислот. Закрепление знаний номенклатуры, способов получения и свойств. Составление схем синтезов кислот, сложных эфиров. Решение расчётных задач Контрольная работа№2 по разделу «Соединения с однородными функциями» 1. Задания по международной и рациональной номенклатуре монофункциональных соединений. 2. Осуществить цепь превращений или сравнить свойства веществ. 3.Решение расчетной задачи Тема 3.6 Нитросоединения Нитросоединения. Классификация. Изомерия, номенклатура. Донорно-акцепторная связь. Получение нитросоединений. Свойства. Влияние нитрогруппы. Нитробензол. Нитротолуол. Применение. Лабораторные занятия№12 Сравнение условий нитрования бензола, нитробензола, фенола, толуола, нафталина.
Тема 3.7 Амины Амины, их классификация. Строение, изомерия, номенклатура. Характеристика свойств Анилин. Получение в промышленности. Реакция Н.Н. Зинина. Химические свойства. Применение анилина. Лабораторное занятие№13 Исследование свойств анилина
Тема 3.8 Диазосоединения Ароматические диазосоединения. Реакция диазотирования. Свойства. Реакция азосочетания. Азокрасители.
Тема 4.2 Аминокислоты Аминокислоты. Строение, изомерия, номенклатура. Способы получения. Синтез альфа-аминокислот Н.Д. Зелинским. Химические свойства. Отношение к нагреванию. Тема 4.3 Углеводы Углеводы. Общая формула, классификация. Нахождение в природе, применение. Моносахариды: глюкоза, фруктоза. Строение, таутомерия. Стереоизомерия моносахаридов. Свойства Дисахариды, строение, восстанавливающие и невосстанавливающие дисахариды. Сахароза, мальтоза: свойства. Полисахариды: крахмал, клетчатка. Строение, физические и химические свойства применение. Лабораторное занятие№14 Изучение свойств глюкозы и сахарозы Лабораторное занятие№15 Изучение свойств крахмала и клетчатки
Лабораторное занятие№16 Исследование свойств белков Вопросы для самоконтроля знаний по разделу «Строение органических веществ» 1 Что такое органическая химия? Назовите предмет изучения органической химии. 2 Сформулируйте основные положения теории химического строения органических соединений А.М. Бутлерова. Приведите примеры практического подтверждения этой теории. 3 Чем объясняется многообразие органических соединений? 4 Что такое электронная орбиталь? Изобразите схематически орбитали 1s -, 2s - и 2р – электронов. 5 Объясните понятие «гибридизация орбиталей». Какие типы гибридизации возможны для атома углерода? 6 Какие связи называют кратными? Из какой комбинации связей состоит двойная и тройная связь? 7 Какие вы знаете два механизма разрыва ковалентной связи? Приведите примеры.
Химические свойства алканов
Алканы проявляют высокую химическую устойчивость. Это обусловлено прочностью всех σ - связей, как углерод-углеродных, так и углерод-водородных. Для алканов характерны реакции: 1 Галогенирование (замещение галогеном). Сравнительно легко алканы вступают в реакцию замещения с хлором и бромом, очень трудно – с иодом. Реакция имеет цепной характер. Например, хлорирование метана, (схема):
2 Реакция нитрования. Реакция Коновалова. Алканы нитруются разбавленной азотной кислотой:
Легче всего замещается водород при третичном атоме углерода, труднее - при вторичном, ещё труднее - при первичном. 3 Реакция сульфохлорирования:
4 Крекинг
5 Изомеризация
6 Ароматизация
7 Окисление
Методы получения
В природе алкены встречаются редко. Газообразные алкены (этилен, пропилен, бутилены) выделяют из газов нефтепереработки (при крекинге) или попутных нефтяных газов. 1 В промышленности алкены получают а) дегидрированием алканов в присутствии катализатора Сr2Оз. Например:
б) Крекинг
В нашей стране более 80% этилена получают пиролизом бензина, около 10% -дегидрированием этана. 2 Лабораторные способы: а) дегидратация спиртов (отщепление воды)
В таких реакциях водород отщепляется от наименее гидрогенизованного атома углерода (с наименьшим числом атомов водорода) - правило Зайцева А.М. б) Отщепление галогеноводорода от галогеналкилов при действии на них спиртового раствора щелочи
Химические свойства
Алкены обладают значительной реакционной способностью. π - связь, как наименее прочная, при действии реагента разрывается, а освободившиеся валентности затрачиваются на присоединение атомов молекулы реагента (σ - связь сохраняется). 1 Гидрирование (присоединение водорода) в присутствии катализаторов Рt, Ni, Рd
2 Галогенирование
3 Гидрогалогенирование
Присоединение идёт по правилу В.В. Марковникова, при обычных условиях водород присоединяется по месту двойной связи к наиболее гидрогенизированному атому углерода, а галоген к менее гидрогенизованному.
4 Реакция гидратации (присоединение воды)
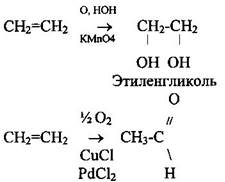
5 Окисление. Реакция Вагнера (качественная реакция):
6 Полимеризация
7 Реакции замещения (термическое хлорирование этилена) 1300°-600°С
8 Реакция алкилирования, в результате которой получаются разветвленные алканы ценные компоненты для повышения качества бензина.
Гомологический ряд
СН ≡ СН – ацетилен (этин) СН ≡ СН –СН3 – пропин СН3 - С ≡ С – СН3 – бутин-2
Методы получения
1 Дегидрогалогенирование (отщепление галогеноводородов от дигалогенпроизводных углеводородов под действием спиртовых растворов NаОН и КОН)
2 Крекинг метана (природного газа)
3 Из карбида кальция
Химические свойства
Для алкинов характерны реакции присоединения, протекающие в 2 стадии: сначала образуются алкены, а затем алканы.
1 Присоединение водорода
2 Присоединение галогенов (галогенирование)
3 Присоединение галогеноводорода (гидрогалогенирование)
4 Присоединение воды (реакция Кучерова)
5 Присоединение синильной кислоты
Используется для производства синтетического каучука и синтетических волокон. Алкины также способны вступать в реакции замещения, полимеризации и окисления.
Методы получения
1 Из этилового спирта по методу С.В. Лебедева
2 Дегидрирование бутана, бутенов (600°С, катализатор Сr2О3 (Аl2О3).Сырьем служит бутан-бутеновая фракция крекинг-газов нефти, а также попутный нефтяной газ
Изопентан выделяют из нефтяных фракций и получают каталитической изомеризацией нормального пентана.
Химические свойства
Для сопряжённых диенов характерны реакции присоединения, которые протекают двояко: в концевые положения системы - положения 1.4 с образованием новой двойной связи между атомами 2 и 3 или по месту одной из двойных связей, другая связь остаётся незатронутой. Первый тип называют 1.4 - присоединением, второй - 1.2-присоединением:
Аналогично идёт реакция присоединения галогенводорода. Реакции полимеризации сопряжённых диенов служат для получения каучуков:
Изомерия. Номенклатура Все шесть атомов водорода в молекуле бензола одинаковы, поэтому при замещении одного (любого из них) на один и тот же радикал, образуется одно и тоже соединение. Однозамещённый бензол изомеров не имеет. Например,существует только один метилбензол (толуол). При замещении двух атомов водорода образуется три изомера - орто-, мета-, пара-.
Основные источники получения ароматических углеводородов - сухая перегонка каменного угля (в каменноугольной смоле содержится свыше 300 ароматических углеводородов) и нефтепереработка: 1 Ароматизация алканов, циклоалканов:
Из октана могут быть получены этилбензол, ксилолы (3 изомера), из гептана → толуол. 2 Полимеризация ацетилена и его гомологов
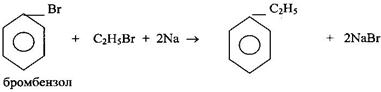
3 Синтез Вюрца - Фиттига
4 Алкилирование ароматических углеводородов галогенпроизводными и алкенами. Реакция Фриделя - Крафтса:
5 Дегидрирование этилбензола
Химические свойства
1 Нитрование
2 Галогенирование
Галогенирование гомологов бензола (свет, тепло) проходит с замещением водорода в радикале (боковой цепи).
Пример:
3 Сульфирование
4 Алкилирование
5 Реакция присоединения идут трудно
6 Окисление Устойчивость бензольного ядра к окислению является одним из важнейших свойств ароматических соединений. При действии окислителей на гомологи бензола окислению подвергаются боковые цепи - радикалы.
Вопросы для самоконтроля знаний по разделу «Углеводороды»
1 Какие из приведенных соединений являются гомологами метана: С2Н2, СзН6, С4Н10, С7Н16,С6Н6, С5Н12? 2 Какие атомы углерода называют первичными, вторичными, третичными, четвертичными? Приведите формулы соединений, содержащих эти атомы. 3 Назовите по систематической номенклатуре следующие углеводороды:
4 Напишите структурные формулы следующих углеводородов: а) 3,3 – диметилпентан; 6)3,5- диметил-4-этилгексен-2; в) 3 - метилпентин-1. 5 Напишите структурные формулы изомерных углеводородов следующих алканов, алкенов, ароматических углеводородов состава: С6Н14, С5Н10, С8Н10. Назовите. 6. Осуществите схемы превращений: а) Метан → ацетилен → бензол → нитробензол. б) Этилен → этилхлорид → бутан -→ бутен – 1. в) Ацетилен → этилен → бутан → бутадиен 1.3. 7 Какой ароматический углеводород получится при каталитической дегидроциклизации гептана? 8 В каких условиях осуществляются следующие превращения: а) Толуол б) Бутен в) Бутен - 1 9 С помощью каких реакций можно различить: а) стирол и этилбензол; б) бензол и толуол; в) этилен и ацетилен? 10 Выведите молекулярную формулу углеводорода, содержащего: ω (С) = 85,7% и ω (Н) = 14,3%. Плотность паров по водороду равна 21. Галогенопроизводные
Производные углеводородов (алканов, алкенов, циклоалканов, ароматических углеводородов), в молекулах которых один или несколько атомов водорода замещены галогеном, называются галогенпроизводными.
В ненасыщенных галогенпроизводных начало нумерации определяет двойная связь - она старшая.
При изучении способов получения галогенпроизводных можно использовать материал прошлых тем: галогенирование алканов, алкенов, алкинов, алкадиенов, циклоалканов, ароматических углеводородов, и их получение. При изучении химических свойств могут быть также использованы методические рекомендации для изучения этих же тем. Следует обратить внимание на различные реакции галогенпроизводных с водными растворами щелочей (реакция замещения с образованием спиртов) и с их спиртовыми растворами (реакция дегидрогалогенирования с образованием непредельных углеводородов). Спирты (Алкоголи). Фенолы
Соединения, в которых группа (ОН) непосредственно связана: а) с углеводородным радикалом, называются спиртами R – ОН; б) с ароматическим радикалом, называются фенолами АrОН.. По количеству гидроксильных групп (ОН) эти соединения делятся на: одноатомные - одна гидроксигруппа; двухатомные - две гидроксигруппы; трёхатомные — три; многоатомные - гидроксигрупп более трёх. В зависимости от того, при каком атоме углерода находится гидроксил, спирты делятся на: а) первичные R-СН2ОН
Названия спиртов производят от названия алканов с добавлением суффикса – ол. Главную цепь нумеруют с того конца, к которому ближе расположена гидроксильная группа. СНзОН – метанол
СН3СН2ОН – этанол
СНзСН2СН2ОН – пропанол - 1 (первичный спирт)
СНз-СН-СНз- пропанол - 2 или изопропиловый спирт (вторичный спирт)
Методы получения спиртов
1 Присоединение воды к алкенам (гидратация)
2 Гидролиз галогенопроизводных (с водой или водным раствором щелочей)
СН3СН2Вr + НОН → СН3СН2ОН + НВr
Если в молекуле имеются 2 атома галогенов, расположенные у разных атомов углерода, то в результате реакции образуются двухатомные спирты.
3 Восстановление альдегидов и кетонов
Химические свойства спиртов
1 Взаимодействие со щелочными металлами (спирты проявляют кислотные свойства)
2СН3-СН2ОН + 2Nа → 2СН3СН2ОNа + Н2 этилат (алкоголят) натрия
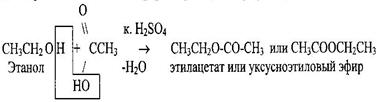
2 Образование простых эфиров СН3СН2ONа + С2Н5Сl → СН3-СН2-О-СН2-СН3+NаСl диэтиловый эфир 3 Образование сложных эфиров - реакция этерификации
4 Замена гидроксила на галоген
СНзОН + НВr → СН3Вr + Н2О 5 Отщепление воды а) внутримолекулярная дегидратация (по правилу Зайцева)
б) межмолекулярная дегидратация
6 Окисление спиртов а) окисление первичных спиртов: в мягких условиях приводит: к образованию альдегидов, в жёстких условиях - к образованию кислот.
При окислении б) при окислении вторичных спиртов образуются кетоны
1 Гидролиз галогенопроизводных
2 Кумольный метод (на Омском заводе СК)
Более новый способ - циклогекановый:
Химические свойства фенола
Как у спиртов, так и у фенолов имеется гидроксильная группа, которая также проявляет кислотные свойства. Группа ОН - ориентант I рода повышает электронную плотность в ароматическом ядре, ароматическое ядро увеличивает подвижность атома водорода в гидроксигруппе. Реакции с участием гидроксигруппы: 1 Взаимодействие с раствором щёлочи
С6Н5ОН + NaOH → С6Н5ОNа +Н2О фенолят натрия
2 Образование простых эфиров
Реакции с участием ароматического ядра: 1 Галогенирование Фенолы галогенируются легче, чем бензол и его гомологи. В результате получаются орто- и пара- изомеры.
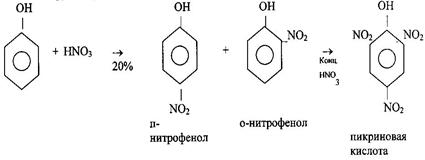
2 Нитрование Фенол нитруется разбавленной азотной кислотой
3 сульфирование
Альдегиды и кетоны
Для альдегидов и кетонов характерно наличие в молекуле карбонильной группы С=О. В альдегидах данная группа связана с радикалом и водородом – R-СНО, в кетонах с двумя радикалами – R-СО-R. Название альдегидов составляют из названий соответствующих алканов с добавлением суффикса «аль», у кетонов «он» с указанием положения карбонильной группы в углеродной цепи. Химические свойства
Альдегиды и кетоны – химически активные вещества. 1 Присоединение водорода (реакция восстановления)
этаналь этанол
пропанон пропанол-2 2 Присоединение цианистого водорода
3 Окисление альдегидов и кетонов. Реакция «серебряного зеркала» (качественная реакция) для альдегидов.
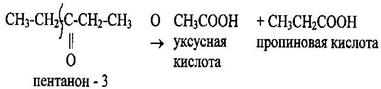
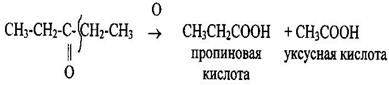
Кетоны окисляются в жёстких условиях с разрывом углеродной цепи. Окислению подвергаются атомы углерода, связанные непосредственно с карбонильной группой
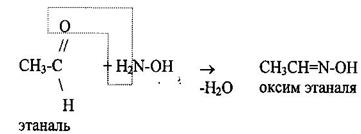
4 Реакции замещения альдегидов и кетонов. Реакция с гидроксиламином NН2-ОН
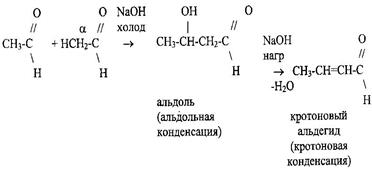
5 Реакции альдольной и кротоновой конденсации альдегидов. Одна молекула альдегида участвует в реакции своим кислородным атомом, другая α-водородным атомом.
Или по типу кротоновой конденсации
Методы получения
1 Карбоновые кислоты можно получить реакцией окисления алканов, алкенов, спиртов, альдегидов, кетонов, гомологов бензола.
2 Гидролиз тригалогенопроизводных
3 Гидрокарбоксилирование алкенов
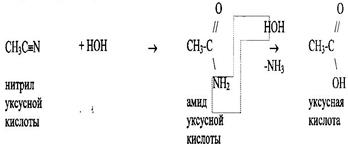
4 Гидролиз нитрилов протекает многостадийно.
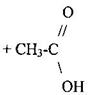
Промышленные способы получения уксусной кислоты: 1 Из углеводородов нефти: <
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-02-19; просмотров: 409; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.148.108.174 (0.093 с.) |


























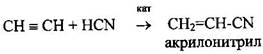
























 метилциклогексан;
метилциклогексан; бутадиен 1.3;
бутадиен 1.3; бутин – 2.
бутин – 2.