Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Первичные иммунодефици-ты гуморального звенаСтр 1 из 15Следующая ⇒
Циты 3.4.2. Нарушения функций нейтрофилов 3.4.3. Нарушения эффекторных функций макро 3.4.4. Дефекты компонентов системы комплемента 3.5.1. Причины вторичных иммунодефицитов 3.5.2. Синдром приобретённого иммунодефицита 3.5.3. Пути передачи ВИЧ-инфекции 3.5.4. Некоторые клинические аспекты ВИЧ- 3.5.5.Иммунопатогенез синдрома приобретённого 3.5.6.Диагностика ВИЧ-инфекции 3.5.7.Принципы терапии ВИЧ-инфекции 3.5.8. Инфекционные заболевания у лиц с ослаб
Рис. 3-1. Первичные и вторичные иммунодефициты Предположение об имеющемся у человека иммунодефиците может быть основано на наличии в анамнезе рецидивирующих или оппортунистических инфекций. Тип патогенного микроорганизма и скорость развития инфекционного заболевания помогают выяснить характер дефекта иммунной системы (рис. 3-2). Например, поломки на уровне врождённого звена иммунитета приводят к острому и тяжёлому течению инфекционного процесса, нередко с его генерализацией. Накопленный в течение многих лет опыт клинических наблюдений за лицами с дефектами иммунной системы позволил сделать следующее заключение. Лица с дефектами гуморального звена иммунной системы, а также системы комплемента, более подвержены развитию бактериальных инфекций, вызываемых внеклеточными патогенами. Инфекционные заболевания, вызываемые внутриклеточными патогенами (вирусами, простейшими и внутриклеточными бактериями) и грибами, развиваются преимущественно на фоне поломок Т-клеточного звена иммунной системы. ГЛАВА 3 з ИММУНОДЕФИ 3.1. Введение 3.2 Первичные иммунодефициты гуморального звена 3.2.1. Диагностика первичных гуморальных имму-
3.2.2. Разновидности первичных гуморальных 3.2.3.Дифференциальная диагностика 3.2.4.Осложнения гуморальных иммунодефицитов 3.2.5.Коррекция гуморальных иммунодефицитов 3.3. Первичные комбинированные (Т- и В-) иммуно 3.3.1.Классификация 3.3.2.Возможности коррекции дефектов Т-клеточ- 3.4. Первичные дефекты неспецифического (естествен 3.4.1. Нарушение функций моноцитов и дендритных клеток Введение С момента рождения человек расстаётся со стерильными условиями внутриутробного периода развития. Большинство микроорганизмов, попадающих в человеческий организм и образующих колонии, не вызывает никаких клинических симптомов и не представляет опасности. Такие бактерии расценивают как полезные. Первая встреча человеческого организма с патогенными бактериями приводит к развитию клинических симптомов заболевания и инициирует развитие иммунного ответа с формированием иммунологической памяти, что надолго (в некоторых случаях, пожизненно) защищает человека от развития заболевания при повторном контакте с патогеном. При каждой встрече с патогеном дальнейшее развитие событий зависит от соотношения между защитными силами организма и вирулентностью патогена, а также от места внедрения возбудителя. Например, некоторые патогены способны вызывать заболевание только на фоне выраженной иммуносупрессии. Такие инфекционные заболевания называют оппортунистическими. Примером оппортунистических инфекций является пневмония, вызываемая Pneumocystis carinii, которая развивается только у лиц с выраженной иммуносупрес-сией (например, у ВИЧ-инфицированных лиц). Дефекты иммунной системы могут быть следствием генетических поломок (первичные иммунодефициты) или результатом воздействия на иммунную систему внешних факторов. К таким факторам относят средовые факторы, питание, лекарственные средства и патогенные микроорганизмы, в первую очередь, вирусы (цитомегаловирус, ВИЧ-1 и др.). Иммунодефициты, обусловленные экзогенными факторами, называют вторичными (рис. 3-1).
ГЛАВА 3
S Клеточный иммунный ответ/Т лимфоциты НШ I Фагоциты Система комплемента (классический и альтернативны! пути активации)
Инфекционные осложнения ~Ш при ослаблении одного из р звеньев иммунного ответа, Генерализация инфекционного процесса дыхательных путей и желудочно-кишечного тракта Вирусные инфекции (диссеминированные) Гастроэнтериты Лимфопролиферативные заболевания Лимфоадениты Инфекционные заболевания кожи Абсцессы печени, легких, Патология урогенитального тракта Генерализованные бактериальные инфекции, Аутоиммунные заболевания
Типичные виды патогенных микроорганизмов^ Гноеродные бактерии Streptococci Staphylococci Haemoptiilus Внутриклеточные патогены Вирусы Цитомегаловирус, Аденовирус Вирус кори Вирус простого герпеса Гноеродные бактерии, Грибы Candida Aspergiltus Pneumocystis cartmt Простейшие Cryptospondium Бактерии Staphylococct ( проявляющие Каталазную активность) Serrate marcescens Klebsiella, E coli Burkholdena cepacia Грибы Candida Aspergittus Гноеродные бактерии Streptococci Netssena
Энтеровирусы Вирус полиомиелита Эховирусы Другие бактерии Salmonella Campylobacter Бактерии Campylobacter Mycobactena Ltstena Бактерии Salmonella Proteus Nocardta He отмечено Вирусы Цитомегаловирус Вирус простого герпеса Рис. 3-2. Инфекционные заболевания и другие патологические состояния, развивающиеся из-за нарушений реакций адаптивного и естественного иммунного ответа Возраст (годы) Дети Взрослые
до 4 лет Транзиторная агаммаглобулинемия новорождённых
4-15 16-60 Вариабельные иммунодефициты Гипер-1§М-синдром Селективные иммунодефициты (IgA, различные под Вариабельные иммунодефициты Селективные иммунодефициты (IgA различные подклассы IgG) Дефицит антителообразования вследствие наличия тимомы Иммунодефициты 69 (в первую очередь антибиотикотерапии) верхний возрастной порог оказался размытым, и есть надежда, что благодаря генотерапии продолжительность жизни больных существенно увеличится. Подробный сбор анамнеза (врезка 3-1) помогает отдифференцировать первичные иммунодефиииты гуморального звена от частых и рецидивирующих бактериальных инфекций в детском возрасте, не являющихся следствием подавления функции гуморального звена иммунной системы. Например, частые бактериальные инфекции респираторного тракта в детском возрасте могут быть следствием сопутствующих заболеваний органов дыхания (муковисцедоза и др.). Для постановки правильного диагноза в данном случае необходимо проведение комплекса лабораторно-инструментальных исследований, направленных на диагностику муковисцедоза и определение титра антител в сыворотке. Врезка 3-1. Признаки, наиболее характерные для гумо Рецидивирующие синуситы и заболевания органов дыхания (см. рис. 3-4):
часто требуют хирургических вмешательств; лобэктомия в детском возрасте и у взрослых; • бронхоэктазы в раннем детском возрасте. • тяжёлые генерализованные инфекционные • инфекционные заболевания кишечника; • менингиты. Инфекции обычно вызываются следующими бактериями (см. рис. 3-2): • Streptococcus pneumoniae; • Haemophilus influenzae. Часто наблюдаются и неинфекционнные заболевания (например, аутоиммунные): • аутоиммунный тиреоидит; аутоиммунная тромбоцитопеническая (геморрагическая) пурпура; • артриты. Вирусные и грибковые инфекции не характерны Специфических клинических проявлений, возникающих вследствие недостаточности содержания антител в сыворотке, не существует. Тем не менее, при обследовании пациента в некоторых случаях выявляют последствия тяжёлых инфекций: перфорацию барабанной перепонки, бронхоэктазы и др. Лабораторные показатели играют ключевую роль в постановке диагноза. В большинстве случаев выявляют снижение уровня сывороточных иммуноглобулинов. Полное исчезновение всех классов иммуноглобулинов (агаммаглобулинемия), бывает крайне редко. У большинства лиц с иммунодефи-цитами гуморального звена антитела классов М и G присутствуют в сыворотке, хотя и в следовых количествах. Дефекты синтеза антител могут затрагивать как отдельные изотипы иммуноглобулинов (например, селективный иммунодефицит IgA), так и сразу несколько типов иммуноглобулинов (наибо- Иммунодефициты гуморального звена нужно рассматривать с точки зрения созревания и дифференцировки В-лимфоцитов. Это позволяет последовательно разобрать гуморальные иммунодефициты, начиная с нарушений начальных этапов развития и дифференцировки В-лимфоцитов и заканчивая конечным этапом их дифференцировки на уровне переключения изотипов иммуноглобулинов. Врождённые иммунодефициты гуморального звена иммунной системы начинают проявляться в возрасте от 4 месяцев до 2 лет. Основным клиническим проявлением являются частые бактериальные инфекции. Развитие бактериальных инфекций в данном возрасте обусловлено постепенным истощением запаса антител класса G, полученного ребёнком от матери в период внутриутробного развития (только иммуноглобулины класса G способны проникать через плацентарный барьер) (рис. 3-3). Некоторые разновидности гуморального иммунодефицита являются следствием дефектов генов, сцепленных с Х-хромосомой или наследуемых по аутосомно-рецессивному признаку. Следовательно, сбор анамнеза и выявление аналогичного заболевания у родственников (в первую очередь у родственников мужского пола) является важным подспорьем в постановке правильного диагноза. Тем не менее, следует подчеркнуть, что отсутствие иммунодефицита у родственников не исключает наличие генетически опосредованной аномалии у пробанда, а также её возникновение вследствие мутации, возникшей de novo (т.е. только в этом поколении).
50 -
Рис. 3-3. Динамика уровня различных классов иммуноглобулинов в детском возрасте. Материнский IgG, прошедший через плацентарный барьер, постепенно разрушается и исчезает из организма ребёнка к шестому месяцу жизни. Результатом этого является «физиологический провал» вуровне IgG, наблюдаемый между 3 и 6 месяцами жизни ребёнка. По мере синтеза собственных IgG уровень данного иммуноглобулина начинает медленно увеличиваться Первичные иммунодефициты — редкие заболевания. Их суммарная частота составляет 1:1000000, или 3 случая на 1000 клинически больных. Эти заболевания встречаются преимущественно в детском возрасте, поскольку значительное число больных не доживает до 20 лет, а у остальных дефекты в определённой степени компенсируются, либо их трактуют в контексте обычной инфекционной или соматической патологии. В последнее десятилетие благодаря успехам лечения Иммунодефициты 71 шенных детей. Именно поэтому у детей, родившихся на сроке беременности 26—32 недели, гораздо чаще возникают бактериальные инфекции. Для профилактики инфекционных заболеваний у недоношенных детей в мировой практике широко используют заместительную терапию иммуноглобулинами до того момента, пока иммунная система новорождённого не заработает в полную силу, и концентрация собственных антител не поднимется до уровня, обеспечивающего надёжную защиту от бактериальных инфекций (см. рис. 3-3). Транзиторная агаммаглобулинемия у детей развивается на первом году жизни вследствие постепенного разрушения материнских JgG, прошедших через плацентарный барьер, и замедленного синтеза собственных JgG. Она является результатом задержки созревания В-лимфоцитов в плазматические клетки (нормальный уровень IgM и IgA в сыворотке и сниженный уровень IgG) вследствие нарушения межклеточных взаимодействий между Т- и В-лимфоцитами. Результатом несостоятельности гуморального звена иммунной системы могут быть частые инфекции верхних дыхательных путей и среднего уха, продолжающиеся до момента нормализации уровня IgG. Уровень IgG обычно нормализуется к 1—2 году жизни ребёнка. Для проведения адекватных профилактических и терапевтических мероприятий крайне важно провести правильную дифференциальную диагностику транзи-торной гипогаммаглобулинемии с патологической. В большинстве случаев состояние детей с транзиторной гипогаммаглобулинемией не вызывает опасений. По некоторым данным для профилактики тяжёлых бактериальных инфекций (при значительном снижении уровня IgG в сыворотке) наряду с профилактическим введением иммуноглобулинов целесообразно проведение профилактических курсов антибиотикотерапии. Необходимость в проведении подобных мероприятий исчезает к 1—2 году жизни ребёнка, когда происходит нормализация содержания IgG в сыворотке за счёт синтеза собственных антител класса G.
Агаммаглобулинемия, сцепленная с Х-хромосомой (болезнь Брутона) Агаммаглобулинемия, сцепленная с X хромосомой, развивается искл ючительно у мальчиков и проявляется частыми гнойными инфекциями в возрасте от 4 месяцев до 2 лет (клинический случай 3-1). Локализация инфекций, а также тип вызывающих их патогенов типичны для иммунодефицитов гуморального звена (см. рис. 3-2, рис. 3-4). Тем не менее, мальчики с болезнью Брутона входят в группу риска по развитию угро--жающих для жизни энтеровирусных инфекций, так как недостаточность выработки секреторного IgA снижает вероятность нейтрализации вирусов. Это делает лиц с нарушенным гуморальным иммунным ответом восприимчивыми к энтеровирусным инфекциям. Клинический случай 3-1. Агаммаглобулинемия, сцепленная с Х-хромосомой (болезнь Брутона) Ребёнок П., родился доношенным, от нормальной беременности, вес при рождении составил 3100 г. В возрасте 3 месяцев у ребёнка развился отит, а в 5 и 11 месяцев он дважды находился на стационарном лечении, где получал антибиотикотерапию по поводу развившейся пневмонии, вызванной Haemophilus influ-enzfte. Анамнез больного без особенностей. При обследовании в возрасте 18 месяцев было выявлено значительное отставание в росте и весе. Кожные покровы бледные. Был проведён полный спектр плановых процедур по вакцинации: в возрасте 2, 3 и 4 месяцев ребенок был иммунизирован противостолбнячным и противодифтерийным анатоксинами, привит против коклюша, менингита и полиомиелита с использованием соответствующих вакцин; в возрасте 15 месяцев привит против кори, эпидемического паротита и краснухи. Результаты всех вакцинаций были неудовлетворительными (таблица 3-4). Об этом свидетельствовали результаты оценки иммунологического статуса, проведённой во время пребывания ребёнка в стационаре по поводу вновь развившейся пневмонии. В частности, было выявлено значительное снижение в сыворотке общего уровня всех трёх классов антител, а также отсутствие антигенспецифических антител класса G против вышеперечисленных патогенов. Несмотря на то, что в анамнезе у ребёнка не было выявлено болезни Брутона, отсутствие в периферической крови зрелых В-лимфоцитов позволило предположить именно это заболевание, причиной которого является блок дифференцировки и созревания В-лимфоцитов. Данный диагноз подтвердили при проведении генетического анализа, выявившего мутации гена, кодирующего тирозинкиназу (так называемого, Btk-гена). Значительное снижение уровня сывороточных иммуноглобулинов явилось основанием для назначения заместительной терапии иммуноглобулинами, вводимыми внутривенно в месячной дозе 400 мг/кг. Продолжительность курсов инфузий составляла 2 недели. В течение последующих 7 лет результаты наблюдения за ребёнком позволили констатировать существенное улучшение всех показателей физического развития и существенное уменьшение частоты развития инфекционных осложнений. Например, за последние 4 года у ребёнка был отмечен всего лишь один случай развития отита. В настоящее время состояние пациента не вызывает опасений. Он получает заместительную терапию иммуноглобулинами, вводимыми в виде подкожных инъекций. ГЛАВА 3 лее часто встречается снижение уровня IgA и IgG). Необходимо отметить, что для выявления предрасположенности пациента к развитию конкретных заболеваний определение в сыворотке изоти-пов антител более информативно, чем определение общего уровня сывороточных иммуноглобулинов. Например, синтез IgGl и IgG3 происходит на антигены белковой природы, в то время как IgG2 вырабатываются на антигены, имеющие в своём составе полисахаридный компонент. Следовательно, у лиц с селективным дефицитом IgG2 имеется большая вероятность развития синуситов, отитов и пневмоний, возбудителями которых являются бактерии, в состав оболочки которых входят полисахариды (Streptococcus pneumoniae, Haemophilus influenzae тип b и Neisseria meningitidis). У лиц с дефектами гуморального звена иммунной системы эффективность вакцинаций существенно снижена, что обусловлено неспособностью иммунной системы вырабатывать антитела. Этот факт нужно учитывать при проведении профилактических мероприятий, связанных с вакцинацией (таблица 3-2). 3.2.2. Разновидности первичных гуморальных иммунодефицитов Подробнее см. таблицу 3-1 и врезку 3-2. Распространённость первичных гуморальных иммунодефицитов отражена в таблице 3-3. Врезка 3-2. Разновидности первичных гуморальных • общий вариабельный иммунодефицит; | • агаммаглобулинемия, сцепленная с Х-хромосо • ranep-IgM-синдром (дефицит CD40L); • селективный иммунодефицит IgA; • транзиторная гипогаммаглобулинемия новорож Таблица 3-3. Распространённость первичных иммунодефицитов гуморального звена
Таблица 3-2. Методы оценки гуморального звена иммунной системы____________________________ Определение уровня антител после перенесённых инфекций (ветряная оспа) Ответ гуморального звена иммунной системы после проведения иммунизации с использованием вакцин, содержащих белковый компонент (столбнячный анатоксин, противокоревая вакцина и др.) и углеводный компонент (липополисахариды бактерий, например, пневмококков, сальмонелл и др.)________________ Предостережения У детей с иммунодефицитами проведение вакцинаций с использованием живых вакцин противопоказано. На вакцины, имеющие в составе углеводный ком Количество В-лимфоцитов составляет 5-15% от общего количества лимфоцитов. Их численность определяют с помощью моноклональных антител к специфическим поверхностным маркёрам. Отсутствие зрелых В-лимфоцитов в периферической крови является патогномо-ничным признаком агаммаглобулинемии, сцепленной с Х-хромосомой. Во всех остальных случаях иммунодефицита гуморального звена количество В-лимфоцитов в периферической крови либо не изменено, либо понижено. Выявление мутаций в результате проведения генетического анализа является окончательным подтверждением наличия врождённого гуморального иммунодефицита. Проведение заместительной терапии, заключающейся во введении иммуноглобулинов, является одним из методов патогенетической терапии данных состояний, используемых с лечебной и профилактической целью. Распространённость
Конкретного заболевания Других нозологических групп Ревматоидный артрит Инсулинозависимый сахарный диабет
Рассеянный склероз Системная красная волчанка Первичные гуморальные имму-нодефициты Склеродермия ГЛАВА 3 Таблица 3-4. Иммунный статус ребёнка с агаммаглобу- Содержание иммуноглобулинов в сыворотке (г/л)
IgG 0,17 _________ (5,5-10,0) норма________ отсутствует
IgM 0,07 Функциональная активность антител, оцениваемая Антиген-специфические антитела класса G (IgG) не выявлены к:_________________________________ Столбнячному анатоксину Вирусу кори Вирусу полиомиелита_________________________ Вирусу краснухи_____________________________ IgM, являющиеся изогемагглютининами (группа крови А, резус-положительная), отсутствуют______ Популяционный состав лимфоцитов в периферической крови (х!0"/л)
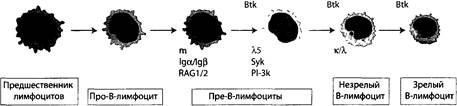
Содержание Заболевание проявляется резким снижением содержания (вплоть до полного отсутствия) в сыворотке всех классов иммуноглобулинов и является результатом блокады дифференцировки и созревания пре-В-клеток, что приводит к отсутствию в организме В-лимфоцитов и плазматических клеток. Причина отсутствия клеток, продуцирующих антитела, заключается в мутации гена, кодирующего тирозинкиназу Btk (Bruton's tyrosine kinase) и обуславливающего экс- прессию на пре-В-клетках рецептора, который делает их чувствительными к факторам, обеспечивающим дифференцировку (рис. 3-5). Этот фермент взаимодействует с липидами на внутренней поверхности мембраны В-лимфоцитов в зоне расположения анти-ген-распознающего рецептора и является ключевым для последующего созревания и дифференцировки В-лимфоцитов. Таким образом, у лиц с агаммаглобу-линемией Брутона наблюдается почти полное отсутствие В-лимфоцитов в крови, в то время как количество и функции Т-лимфоцитов не нарушены. Симптомы заболевания начинают развиваться после истечения срока жизни материнских антител (IgG), прошедших через плацентарный барьер. Окончательный диагноз помогает установить выявление дефектного гена в X хромосоме. 100 -1
Рис. 3-4. Распространённость поражений различных органов| и систем у больных первичными гуморальными иммуноде-фицитами.
Рис. 3-5. Дифференцировка В-лимфоцитов. Красным цветом отмечены белки, мутации j генов которых могут привести! нарушениям дифференцировк: В-лимфоцитов и нарушению синтеза антител Терапия данного заболевания заключается во введении больших доз иммуноглобулинов, проведении антибиотикотерапии при наличии бактериальных инфекций, профилактике развития бронхоэктазов 1 других осложнений (рис. 3-6).
или IgA. В результате образуются только IgM. При этом заболевании нарушена и функция Т-клеток, не получающих сигналы противоположной направленности вследствие отсутствия молекулы CD40L. Отсутствие сигнала, воспринимаемого В-лимфоцитами с помощью молекулы CD40, отрицательным образом сказывается на экспрессии на поверхности В-лимфоцитов других молекул (например, молекул, обеспечивающих проведение ко-стимулирующего сигнала — CD80 и CD86). В отсутствии экспрессии молекул данного типа на поверхности В-лимфоцитов их взаимоотношения с Т-лимфоцитами не приводят к полноценной активации Т-клеток. Это приводит к нарушениям функционирования Т-клеточного звена иммунной системы и, в частности, препятствует формированию эффективного противоопухолевого иммунитета. Именно поэтому с возрастом у лиц с гипер-1§М-синдромом повышается частота развития злокачественных новообразований. Отсутствие экспрессии CD40L на тимоцитах препятствует процессам селекции тимоцитов и элиминации аутореактивных клонов клеток. Это приводит к повышению частоты развития аутоиммунных заболеваний, в том числе, неитропении аутоиммунного происхождения (клинический случай 3-2).
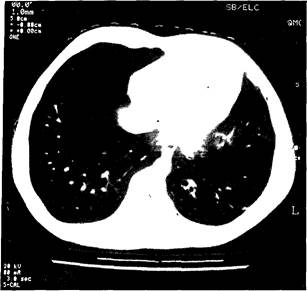
делает ЮЩИМ заимо- (НОСТИ анти-чевым гровки глобу-тсутс-гество ттомы чения:дших [агноз га в X Рис. 3-6 Бронхоэктазы — типичные для бронхоэктазов признаки нарушения структуры конечных бронхиол, приводящих к структурным повреждениям легочной ткани а — данные компьютерной томографии, б — данные бронхоскопии L анов це- ш ги к вки 3 И Гипер-1дМ-синдром Гипер-^М-синдром — первичный иммунодефицит с Х-ецепленным типом наследования, развивающийся при дефекте гена, кодирующего молекулу CD40L. У таких больных на фоне снижения общего количества иммуноглобулинов в сыворотке наблюдается селективное повышение уровня IgM. Кроме того, у данной группы лиц не наблюдается снижения количества В-лимфоцитов. Данное патологическое состояние называют гипер-1§М-синдромом (клинический случай 3-2). Лица с rHnep-IgM-синдромом подвержены частым рецидивирующим заболеваниям дыхательных путей, тонзиллитам, синуситам, отитам. У ряда лиц развиваются оппортунистические инфекции. Типичным примером оппортунистических инфекций, развивающихся при этом патологическом состоянии, является пневмония, вызываемая Pneumocystiscarinii. Гипер-IgM-синдром является следствием нарушений Т-клеточно-го звена иммунной системы, хотя его и относят к имму-нодефицитам гуморального звена. В основе патологии лежит нарушение экспрессии на Т-клетках молекул CD154 (CD40L), являющихся лигандами рецепторов CD40 на поверхности В-клеток (рис. 3-7). В результате в В-клетку не передаётся сигнал, ответственный за переключение синтеза иммуноглобулинов с IgM на IgG Проведение генетического анализа выявило делецию Таблица 3-5. Иммунный статус ребёнка с дефектом экспрессии CD40L (клинический случай 3-2) ___________ Уровень белков сыворотки___________
Альбумин С-реактивный белок Иммуноглобулины IgG I МГ/Л 0,9 г/л
Общее количество лимфоцитов_____ Т-лимфоциты менее 0,07 г/л 3,2 г/л
(1,5-3,50) норма
CD3 1,5 (0,9-2,8
CD4 (0,6-1,2)
CD8 0,7 (0,4-1,0) В-лимфоциты CD19 0,4 (0,2-0,4) NK-лимфоцит ы CD16/CD56 0,2 (0,2-0,4) Ответ лимфоцитов на стимуляцию До стимуляции* После стимуляции* CD69 CD71 CD40L CD69 CD71 CD40L
*— -rfm/vfcrva хм'тл- д %, ^/считывалось по отношенмк к общему количеству Т-лимфоцитов (т.е. СШ-позитивных лимфоцитов) ГЛАВА 3 ГЛАВА 3 Клинический случай 3-3. Общий вариабельный иммунодефицит Женщина 64-х лет поступила в клинику с острой долевой пневмонией и опоясывающим лишаем. В течение последних 5 лет она дважды лежала в стационаре с пневмонией. После проведения соответствующего лечения пациентка выписывалась из клиники в удовлетворительном состоянии без каких-либо остаточных симптомов заболевания. В детском возрасте тяжёлых и часто повторяющихся инфекционных заболеваний органов дыхания отмечено не было. В возрасте 35 лет больная отмечает приступ серонегативного артрита. При сборе анамнеза удалось выявить, что были эпизоды диареи, наблюдавшиеся у больной в позднем юношеском возрасте. Продолжительность подобных эпизодов составляла от 2 дней до 2 недель с частотой дефекации до 6 раз в сутки. Семейный анамнез без особенностей, женщина замужем, имеет двух сыновей в возрасте 30 и 37 лет без аналогичных признаков заболевания. При обследовании выявлено: уровень гемоглобина соответствует норме (115 г/л), содержание нейтрофи-лов и лимфоцитов — в пределах нормы. Содержание Т- и В-лимфоцитов в периферической крови в пределах нормы. При проведении бактериологического анализа кала патогенов не выявили. Каких-либо органических изменений со стороны органов желудочно-кишечного тракта с применением инвазивных методов диагностики выявить не удалось. При исследовании содержания иммуноглобулинов сыворотки (таблица 3-6) было выявлено значительное снижение их уровня. Также не удалось выявить антигенспе-цифических IgG, несмотря на то, что больная получила 1 год назад бустерную дозу вакцины против Streptococcus pneumoniae, а также столбнячного анатоксина. Таким образом, методом исключения больной был поставлен диагноз общего вариабельного иммунодефицита и назначены двухнедельные курсы заместительной терапии в виде внутривенных инфузий пре- паратов иммуноглобулина в месячной дозе 400 мг/кг. Таблица 3-6. Иммунный статус пациента с общим Содержание иммуноглобулинов в сыворотке (г/л) IgG 3,15 (7,2-19,0) норма
(0,8-5,0)
(0,5-2,0) _______ Функциональная активность антител_______
Ответ на иммунизацию — антигенспецифичные антитела класса G (IgG) к следующим патогенам Столбнячный анатоксин (норма не менее 0,85 МЕ/мл)
Дифтеритический анатоксин (норма не менее 0,2 МЕ/мл)
Пневмококковый полисахарид (норма не менее 80 МЕ/мл) Популяционный состав лимфоцитов в периферической крови (х!09/л)
Данная форма иммунодефицита проявляется значительным снижением уровня сывороточных иммуноглобулинов (в первую очередь IgG), а также секреторного IgA на фоне нормального содержания В-лимфоцитов. Также характерно отсутствие герминативных центров и плазматических клеток в лимфоузлах и селезёнке, что является результатом блокады созревания В-лимфоцитов в плазматические клетки (т.е. блок созревания происходит на более поздней стадии по сравнению с агаммагло-булинемией, сцепленной с Х-хромосомой). Симптомы заболевания типичны для этой группы — частые синуситы, отиты, заболевания дыхательных путей, вызванные инкапсулированными патогенами (см. рис. 3-2 и рис. 3-4). Тем не менее, у 90% пациентов с общим вариабельным иммунодефицитом симптомы развиваются постепенно и достигают максимума к 15—20 годам жизни. У лиц с общим вариабельным иммунодефицитом имеется склонность к развитию аутоиммунных заболеваний, хронических заболеваний органов дыхания, диареи и синдрома мальабсорбции. Примерно 1/3 больных с вариабельным иммунодефицитом имеет нарушения клеточного звена. Принципы терапии при данной патологии такие же, как при гипогаммаглобулинемии, сцепленной с Х-хромосомой, и заключаются в проведении заместительной терапии иммуноглобулинами. Осложнения у данной группы лиц весьма разнообразны. Это выглядит вполне логичным, так как общий вариабельный иммунодефицит является следствием множества генетических дефектов и сопровождается самыми разнообразными нарушениями гуморального звена иммунной системы. Селективные дефициты IgG
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-02-10; просмотров: 513; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.129.19.251 (0.165 с.) |

 Гуморальный иммунный ответ/В лимфоциты
Гуморальный иммунный ответ/В лимфоциты ^^Hpefreexap
^^Hpefreexap
 Перенос материнского IgGr"
Перенос материнского IgGr"